Predefinição:Outros usos Predefinição:Elemento/Oxigênio
O oxigénio (português europeu) ou oxigênio (português brasileiro) é um elemento químico de número atómico 8 e símbolo O (8 protões e 8 eletrões) representando com massa atómica 16 u. Constitui parte do grupo dos calcogénios e é um não metal reactivo e um forte agente oxidante que facilmente forma compostos com a maioria doutros elementos, principalmente óxidos. Tem a segunda electronegatividade mais elevada de todos os elementos químicos, superado apenas pelo flúor.[1] Medido pela sua massa, o oxigénio é o terceiro elemento mais abundante do universo, atrás do hidrogénio e hélio,[2] e o mais abundante na crosta terrestre como parte de compostos óxidos, formando praticamente metade da sua massa.[3] Em condições normais de pressão e temperatura, dois átomos do elemento ligam-se para formar o dioxigénio, um gás diatómico com fórmula Predefinição:Chem. Este gás diatómico constitui 20,8% da atmosfera e é fundamental para suportar a vida terrestre.[4] Não obstante, vários estudos dos níveis de oxigénio atmosférico indicam uma progressão global descendente na proporção deste elemento, principalmente por causa das emissões procedentes da queima de combustíveis fósseis.[5]
É um gás incolor (azul em estado líquido[6] e sólido), inodoro e Predefinição:Linktext, comburente, não combustível e pouco solúvel em água. O dioxigénio é usado na respiração celular e muitas das principais moléculas orgânicas dos organismos vivos como proteínas, ácidos nucleicos, carboidratos e lípidos contêm oxigénio, além dos principais compostos inorgânicos que formam as conchas, os dentes e os ossos dos animais. A maior parte da massa dos organismos vivos é composta por oxigénio enquanto componente da água, o principal constituinte das formas de vida. Devido à sua reactividade química, o oxigénio não pode permanecer na atmosfera terrestre como elemento livre sem que seja constantemente reabastecido pela acção fotossintética dos organismos que utilizam a energia solar para produzir oxigénio a partir da água. O oxigénio elementar O2 somente começou a acumular-se na atmosfera depois do aparecimento destes organismos, há aproximadamente 2 500 milhões de anos.[7] O alótropo ozono (Predefinição:Chem) é um forte absorvente de radiação ultravioleta, e a camada de ozono da Terra, a grande altitude, ajuda a proteger a biosfera da incidência de radiação procedente do Sol. Porém, o ozono é um agente contaminante perto da superfície terrestre, sendo um produto derivado do smog. A altitudes de órbita terrestre baixa, o oxigénio atómico presente provoca a corrosão das naves espaciais.[8]
O oxigénio foi descoberto autonomamente por Carl Wilhelm Scheele em Uppsala, no ano de 1773, e por Joseph Priestley em Wiltshire no ano de 1774, no entanto é Priestley quem costuma ser designado prioritariamente, uma vez que a sua obra foi a primeira a ser publicada. Em 1777, Antoine Lavoisier cunhou o seu nome[9] e suas experiências com o oxigénio ajudaram a desacreditar a até então popular teoria do flogisto da combustão e corrosão. O nome deriva do grego ὀξύς (oxys) («ácido», literalmente «picante», em alusão ao sabor dos ácidos) e γόνος (-gonos) («produtor», literalmente «gerar»), porque na época em que se lhe deu esta denominação acreditava-se, equivocadamente, que todos os ácidos necessitavam de oxigénio para a sua composição. As aplicações habituais do oxigénio incluem, entre outras, o seu uso em calefações residenciais e motores de combustão interna, a produção de aço, plásticos e têxteis, aplicações de corte industrial e soldadura de aços e outros metais, como propulsor para foguetes, para terapias de oxigénio e sistemas de suporte à vida em aeronaves, submarinos, naves espaciais tripuladas e mergulho.
Características principais
Estrutura molecular e propriedades
Nas Condições Normais de Temperatura e Pressão (PTN), o oxigénio é um gás incolor e inodoro com fórmula molecular O2, em que dois átomos de oxigénio se ligam com uma configuração electrónica em estado tripleto. Esta ligação apresenta uma ordem de ligação de dois e costuma-se simplificar nas descrições como uma ligação dupla[10] ou como uma combinação duma ligação de dois electrões e duas ligações de três electrões.[11]
O oxigénio tripletoPredefinição:Efn é o estado fundamental da molécula O2,[12] que apresenta dois electrões desemparelhados que ocupam dois orbitais moleculares degenerados.Predefinição:Efn Estes orbitais são classificados como antiligações - debilitam a ordem de ligação de três para dois-, de forma a que a ligação do dioxigénio é mais fraca do que a tripla ligação do nitrogénio diatómico, em que todos os orbitais das ligações moleculares são preenchidos, mas alguns orbitais de antiligação não.[12][13]
Na sua forma normal de tripleto, as moléculas de O2 são paramagnéticas; ou seja, na presença dum campo magnético formam um íman, devido ao momento magnético do spin dos electrões desemparelhados na molécula e à interação de troca negativa entre moléculas de O2 contíguas.[14] O oxigénio líquido é de tal forma magnético que, em demonstrações laboratoriais, um fio de oxigénio líquido pode suster o seu próprio peso entre os polos dum íman potente.[15]Predefinição:Efn
O oxigénio molecular singlete é um nome dado a várias espécies de O2 de maior energia, em que todos os spins dos electrões se emparelham. É muito mais reactivo com moléculas orgânicas comuns do que o oxigénio molecular propriamente dito. Na natureza, o oxigénio singlete costuma formar-se com a água durante a fotossíntese, utilizando a energia solar.[16] É também produzido na troposfera por meio da fotólise do ozono pela luz de onda curta[17] e pelo sistema imunitário enquanto fonte de oxigénio activo.[18] Nos organismos fotossintéticos - e possivelmente também nos animais - os carotenoides exercem um papel fundamental na absorção de energia do oxigénio singlete e na conversão deste para o seu estado não excitado antes de provocar danos nos tecidos.[19]
Alótropos

O alótropo comum do oxigénio elementar é o chamado dioxigénio (O2), que possui um comprimento de ligação de 121 pm e uma energia de ligação de 498 kJ•mol−1,[20] menor que a energia das outras ligações duplas ou pares de ligações simples presentes na biosfera, e responsável pela reação exotérmica do O2 com qualquer molécula orgânica.[21][22] Devido ao seu teor de energia, o O2 é utilizado por formas de vida complexas, tal como os animais, na sua respiração celular, desempenhando um papel fundamental na composição da atmosfera terrestre.
O trioxigénio (O3) é habitualmente conhecido como ozono e é um alótropo bastante reactivo, prejudicial para o tecido pulmonar.[23] O ozono é produzido na atmosfera superior quando o O2 se combina com o oxigénio atómico causado pela divisão do O2 por radiação ultravioleta.[9] Uma vez que o ozono é um poderoso absorvente na região ultravioleta do espectro electromagnético, a camada de ozono da atmosfera superior funciona como um escudo protector da radiação que o planeta recebe.[9] Perto da superfície terrestre, todavia, é um contaminante formado como subproduto das emissões de automóveis.[23] A molécula metaestável do tetraoxigénio (O4) só foi descoberta em 2001,[24][25] e assumiu-se que existia numa das seis fases do oxigénio sólido. Em 2006 demonstrou-se que esta fase, criada por meio da pressurização do O2 a 20 GPa, é, de facto, um cluster Predefinição:Efn O8 do sistema trigonal.[26] Este cluster tem potencial para ser um oxidante muito mais potente do que o O2 e o O3 e pode, por conseguinte, ser usado como propulsor de foguetes.[24][25] Em 1990 foi descoberta uma fase metálica quando o oxigénio sólido é submetido a uma pressão superior a 96 GPa[27] e demonstrou-se em 1998 que a temperaturas muito baixas converte-se em supercondutor.[28]
Propriedades físicas

O oxigénio é mais solúvel em água do que o nitrogénio; água em equilíbrio com ar contém aproximadamente uma molécula de O2 por cada duas moléculas de N2, em comparação à proporção atmosférica, de aproximadamente 1:4. A solubilidade do oxigénio na água depende da temperatura, dissolvendo-se em cerca do dobro (14,6 mg•L−1) a 0 °C do que a 20 °C (7,6 mg•L−1).[30][31] A 25 °C e Predefinição:Convert/atmPredefinição:Convert/test/A, a água doce contém cerca de 6,04 mililitros (ml) de oxigénio por litro, enquanto que a água do mar contém cerca de 4,95 ml por litro.[32] A 5 °C a solubilidade aumenta até 9,0 ml (cerca de 50 % mais do que a 25 °C) por litro na água e 7,2 ml (45% mais) na água do mar.[31]
O oxigénio condensa-se a 90,20 K (-182,95 °C, -297,31 °F) e congela a 54,36 K (-218,79 °C, -361,82 °F).[33] Tanto o O2 líquido como o sólido são substâncias claras com uma cor azul céu provocada pela absorção no vermelho, contrastando com a cor azul do céu, que se deve à dispersão de Rayleigh da luz azul. O O2 líquido de grande pureza é obtido através da destilação fracionada do ar liquefeito.[34] O oxigénio líquido também pode ser produzido pela condensação do ar, utilizando nitrogénio líquido como refrigerante. É uma substância altamente reactiva e deve ser separado de materiais inflamáveis.[35]
A espectroscopia do oxigénio molecular associa-se aos processos atmosféricos das auroras e outras emissões de luz na atmosfera.[36] A absorção no contínuo de Herzberg e nas bandas de Schumann–Runge no ultravioleta produz oxigénio atómico, importante na química do meio atmosférico.[37] O oxigénio molecular singlete em estado excitado é responsável pela luminescência química vermelha nas soluções.[38]
Importância da sua existência
O oxigénio é o elemento químico mais abundante, por massa, na biosfera, ar, mar e terra. É o terceiro mais abundante no universo, atrás do hidrogénio e hélio.[2] Cerca de 0,9 % da massa do Sol é oxigénio. Constitui também 49,2 % da massa da crosta terrestre (cerca de 46,7%), e é o principal componente dos oceanos (cerca de 87% como componente da água).[4] O oxigénio gasoso é o segundo componente mais abundante na atmosfera, constituindo 20,8 % do seu volume e 23,1 % da sua massa (cerca de 1015 toneladas).[3][4][39]Predefinição:Efn A Terra é uma excepção entre os planetas do Sistema Solar pela elevada concentração de oxigénio gasoso na sua atmosfera; por exemplo, Marte (com cerca de 0,1 % de O2 do total do seu volume) e Vénus têm concentrações muito inferiores. Contudo, o O2 que circula nestes planetas provém exclusivamente da reação das moléculas que contêm oxigénio, assim como o dióxido de carbono, por efeito da radiação ultravioleta.[40]
Os óxidos de metais, silicatos (SiO44-) e carbonatos (CO32-) encontram-se frequentemente em rochas e no solo. Na atmosfera apresenta-se como oxigénio molecular, O2, dióxido de carbono e em menor proporção como monóxido de carbono (CO), ozono (O3), dióxido de nitrogénio (NO2), monóxido de nitrogénio (NO) ou dióxido de enxofre (SO2). Nos planetas exteriores (mais distantes do Sol) e em cometas encontra-se água congelada e outros compostos de oxigénio; por exemplo, em Marte existe dióxido de carbono congelado.[41] O espectro deste elemento também é com frequência observado nas estrelas.[42]
| Z | Elemento | Fração de massa em partes por milhão |
|---|---|---|
| 1 | Hidrogénio | 739 000 |
| 2 | Hélio | 240 000 |
| 8 | Oxigénio | 10 400 |
| 6 | Carbono | 4 600 |
| 10 | Néon | 1 340 |
A concentração anormalmente elevada de oxigénio gasoso na Terra é resultado do ciclo do oxigénio. Este ciclo biogeoquímico descreve o movimento do oxigénio dentro e entre os seus três principais reservatórios no planeta: a atmosfera, a biosfera e a litosfera. O factor de condução mais importante neste ciclo é a fotossíntese, responsável pela atmosfera moderna da Terra, que libera oxigénio na atmosfera, enquanto que os processos de respiração e descomposição o eliminam.[44]
O oxigénio livre ocorre também em soluções nas massas de água do planeta. A maior solubilidade do O2 a baixas temperaturas tem importantes implicações para a vida marinha, uma vez que os oceanos polares sustentam uma densidade de vida muito maior devido ao seu elevado teor de oxigénio.Predefinição:Efn A quantidade de O2 na água pode ser diminuída pela contaminação hídrica, devido à acção da decomposição das algas e outros biomateriais por um processo denominado eutrofização. Os cientistas avaliam este aspecto da qualidade da água através da medição da sua carência biológica de oxigénio, ou quantidade de O2 necessária para restaurá-la para níveis de concentração normais.[45]
Isótopos e origem estelar
O oxigénio possui dezassete isótopos cujo número de massa varia entre 12 e 28. O oxigénio encontrado na natureza é composto por três isótopos estáveis: O16, O17 e O18, sendo o O16 o mais abundante (99,762 % de abundância natural).[46] A maior parte do O16 é sintetizado no final do processo de combustão do hélio no interior de estrelas massivas, mas outra parte é produzida no processo de combustão do néon.[47] O O17 deriva fundamentalmente da fusão do hidrogénio em hélio durante o ciclo CNO, convertendo-o num isótopo comum nas zonas de combustão de hidrogénio nas estrelas.[47] A maioria do O18 é produzido quando o N14 — que abunda devido à combustão CNO — captura um núcleo de He4, tornando o O18 comum nas zonas ricas em hélio das estrelas massivas.[47]
Foram evidenciados quatorze radioisótopos, dos quais os mais estáveis são o O15 com um período de semidesintegração de 70,606 segundos.[46] Todos os restantes isótopos radioactivos têm períodos de semidesintegração inferiores a 27 segundos e a maior parte destes, inferiores a 83 milissegundos.[46] A forma de desintegração dos isótopos mais leves que o O16 é a desintegração β+[48][49][50] para produzir nitrogénio. O tipo de decaimento mais comum para os isótopos mais pesados do que o O18 é a desintegração β que dá origem ao flúor.[46]
Compostos

Predefinição:VT O estado de oxidação do oxigénio é -2 em quase todos os compostos conhecidos do oxigénio. O estado de oxidação -1 encontra-se em alguns compostos, como os peróxidos.[51] Os compostos noutro estado de oxidação são muito raros: -1/2 (superóxidos), -1/3 (ozónidos), 0 (elementar, ácido hipofluoroso), +1/2 (dioxigenil), +1 (difluoreto de dioxigénio) e +2 (difluoreto de oxigénio).[52]
A sua alta eletronegatividade faz com que reaja com muitos elementos químicos, excepto os gases nobres. O composto mais notável do oxigénio é a água (H2O); outros compostos importantes que apresentam o elemento oxigénio na sua composição são: o dióxido de carbono, os álcoois (R-OH), aldeídos, (R-CHO) e ácidos carboxílicos (R-COOH).
Os radicais clorato (ClO3-), perclorato (ClO4-), cromato (CrO42-), dicromato (Cr2O72-), permanganato (MnO4-) e nitrato (NO3-) são fortes agentes oxidantes. Os epóxidos são éteres nos quais o átomo de oxigénio é um hétero-tomo. O ozónio (O3) forma-se mediante descargas elétricas a partir do oxigénio molecular, como por exemplo, durante as tempestades elétricas. Também já foi encontrado no oxigénio líquido, em pequenas quantidades, uma dupla molécula de oxigénio: (O2)2.
Óxidos e outros compostos inorgânicos
A água (H2O) é um óxido de hidrogénio e é o composto de oxigénio mais comum. Os átomos de hidrogénio estão ligados covalentemente ao oxigénio na molécula de água, mas numa massa de água também são atraídos (cerca de 23,3 kJ•mol−1 por átomo de hidrogénio) pelo átomo de oxigénio doutra molécula de água adjacente.[53] Estas ligações de hidrogénio entre moléculas de água mantêm-nas aproximadamente 15 % mais próximas do que seria espectável num líquido simples apenas com as forças de Van der Waals.[54]Predefinição:Efn

Devido à sua electronegatividade, o oxigénio forma ligações químicas com quase todos os elementos a altas temperaturas para formar óxidos correspondentes. Contudo, alguns elementos formam óxidos directamente em condições normais de pressão e temperatura, como o óxido formado do ferro. As superfícies de metais como o alumínio e o titânio oxidam-se na presença do ar e são revestidas por uma fina camada de óxido que passiva o metal e abranda a corrosão. Alguns dos óxidos metálicos de transição são encontrados na natureza como compostos não estequiométricos, com um pouco menos de metal do que a fórmula química sugere. Por exemplo, o FeO (wustite), que se forma naturalmente, é escrito como Fex-1O, onde o «x» é normalmente cerca de 0,05.[55]
O oxigénio como composto está presente na atmosfera em pequenas quantidades em forma de dióxido de carbono (CO2). A rocha da crosta terrestre é composta por grandes quantidades de óxidos de silício (dióxido de silício SiO2, como o encontrado no granito e quartzo), alumínio (óxido de alumínio Al2O3, em bauxite e corindo), ferro (óxido férrico Fe2O3, na hematite e ferrugem) e cálcio (carbonato de cálcio CaCO3, no calcário). O restante da crosta terrestre é também constituído por compostos de oxigénio, em particular vários silicatos complexos. No manto terrestre, com uma massa muito maior do que a crosta terrestre, abundam os silicatos de ferro e magnésio.
Os silicatos solúveis em água com as formas Na4SiO4, Na2SiO3 e Na2Si2O5 são utilizados em detergentes e adesivos.[56] O oxigénio também actua como ligação para metais de transição, formando ligações de O2 metálico com átomos de irídio no complexo de Vaska,[57] com platina no PtF6 e com o centro de ferro no grupo hemo da hemoglobina.[58]
Compostos orgânicos e biomoléculas
Entre as classes mais importantes de compostos orgânicos que contêm oxigénio mencione-se (onde «R» é um grupo orgânico): álcoois (R-OH), éteres (R-O-R), cetonas (R-CO-R), aldeídos (R-CO-H), ácidos carboxílicos (R-COOH), ésteres (R-COO-R), anidridos de ácido (R-CO-O-CO-R) e amidas (R-C(O)-NR2).[59] Existem muitos dissolventes orgânicos importantes que contêm oxigénio, entre os quais: acetona, metanol, etanol, álcool isopropílico, furano, tetraidrofurano, éter etílico, dioxano, acetato de etila, dimetilformamida, dimetilsulfóxido, ácido acético e ácido fórmico. A acetona (CH3(CO)CH3) e o fenol (C6H5OH) são usados como matérias na síntese de muitas substâncias diferentes.[60] Outros compostos orgânicos importantes que contêm oxigénio são, o glicerol, formaldeído, glutaraldeído, ácido acético e acetamida.[61] Os epóxidos são éteres nos quais o átomo de oxigénio constitui parte dum anel de três átomos.[62]
O oxigénio reage espontaneamente com muitos compostos orgânicos a temperatura ambiente ou inferior, num processo designado autoxidação.[63] A maior parte dos compostos orgânicos que contêm oxigénio não se produzem por acção directa do O2. Os compostos orgânicos importantes na indústria e comércio produzidos por oxidação directa dum precursor incluem o óxido de etileno e o ácido peracético.[56]
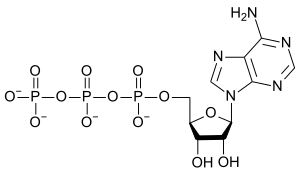
O elemento encontra-se em quase todas as biomoléculas importantes para (ou geradas por) a vida.[64] Apenas algumas biomoléculas complexas comuns, como o esqualeno e o caroteno, não possuem oxigénio. Dos compostos orgânicos com importância biológica, os carboidratos contêm a maior proporção de oxigénio na sua massa. Todas as gorduras, ácidos gordos, aminoácidos e proteínas contêm oxigénio (devido à presença de grupos carbonilos nesses ácidos e nos seus resíduos de éster). O oxigénio também está presente em grupos de fosfato (Predefinição:Chem) nas moléculas biologicamente importantes que transportam energia, ATP e ADP, na coluna vertebral e purinas (à excepção de adenina e pirimidinas de ARN e ADN) e nos ossos como fosfato de cálcio e hidroxiapatita.
História
Uma das primeiras experiências conhecidas sobre a relação entre combustão e o ar foi realizada por Filão de Bizâncio, escritor grego do século II a.C., que tinha como um de seus interesses a mecânica. Na sua obra Pneumatica, Filão observou que invertendo um recipiente sobre uma vela acesa e colocando água em torno do gargalo do vaso, uma parte do líquido subia pelo gargalo.[65] Filão supôs erradamente que partes do ar no recipiente eram convertidas no elemento clássico do fogo e, portanto, eram capazes de escapar através dos poros do vidro. Vários séculos depois, Leonardo da Vinci, com base no trabalho de Filão, observou que uma parte do ar é consumida durante a combustão e respiração.[66]
No final do século XVII, Robert Boyle provou que o ar é necessário para a combustão. O químico inglês John Mayow refinou este trabalho, mostrando que o fogo requer apenas uma parte do ar, que denominou de nitroaereus spiritus ou simplesmente nitroaereus.[67] Num experimento, descobriu que, colocando tanto um rato como uma vela acesa num recipiente fechado sobre água, levava a água a subir e substituir um décimo quarto do volume do ar antes de sufocar os objetos da experiência.[68] A partir disso, supôs-se que o nitroaereus era consumido tanto na respiração como na combustão.
Mayow observou que o antimónio aumentava o seu peso quando aquecido, e inferiu que o nitroaereus deve ter combinado com ele.[67] Também pensava que os pulmões separavam o nitroaereus do ar passando-o para o sangue, e que o calor animal e o movimento dos músculos resultava da reação do nitroaereus com determinadas substâncias no organismo.[67] Relatos dessas e doutras experiências e ideias foram publicados em 1668 na sua obra Tractatus duo no tratado "De respiratione".[68]
Teoria do flogisto

Robert Hooke, Ole Borch, Mikhail Lomonossov e Pierre Bayen produziram oxigénio durante experimentações entre os séculos XVII e XVIII, mas nenhum deles o reconheceu como um elemento.[30] Isto deveu-se em parte à prevalência da filosofia da combustão e corrosão, denominada teoria do flogisto, que era até então a melhor explicação para esses processos.[69]
Esta teoria, estabelecida em 1667 pelo químico alemão Johann Joachim Becher e modificada pelo também químico Georg Stahl em 1731,[70] postulava que todos os materiais combustíveis eram constituídos por duas partes; uma, chamada flogisto, que era emitida ao queimar a substância em questão, e outra, denominada desflogisticado, que era tida como a sua verdadeira forma, o calx (cinza; greda em latim).[66]
Acreditava-se que os materiais altamente inflamáveis que deixam poucos resíduos, como a madeira ou o carbono, eram constituídos essencialmente por flogisto, enquanto que as substâncias não combustíveis que se corroem, como o ferro, continham muito pouco. O ar não desempenhava nenhum papel na teoria do flogisto nem foram realizadas experiências quantitativas para testar a ideia; em vez disso, a teoria baseava-se em observações sobre o que acontece quando um objeto é queimado: os objectos mais comuns pareciam tornar-se mais leves e perdiam algo no processo de combustão.[66] Para justificar o facto de que uma substância como a madeira realmente ganhava peso no seu conjunto durante a combustão, Stahl afirmava que o flogisto possuía massa negativa. Uma das primeiras evidências sobre a falsidade da teoria do flogisto era que os metais também ganhavam peso na oxidação (quando supostamente perdiam flogisto).[69]
Descoberta

A descoberta se deu pelo farmacêutico sueco Carl Wilhelm Scheele, que produziu oxigénio gasoso aquecendo óxido de mercúrio e vários nitratos por volta de 1772.[4][66] Scheele chamou ao gás "ar do fogo", porque era o único apoio conhecido para a combustão, e escreveu um relatório sobre a sua descoberta em um manuscrito intitulado "Chemische Abhandlung von der Luft und dem Feuer» ( «Tratado químico do ar e do fogo" ) e enviou-o para a sua editora em 1775; no entanto, só em 1777 é que o documento foi publicado.[71]

O seu trabalho não teve reconhecimento imediato, sendo a descoberta ocasionalmente atribuída a Joseph Priestley, que elaborou uma experimentação independente a 1 de agosto de 1774. Este realizou uma experiência no qual focou a luz solar sobre óxido de mercúrio (II) (HgO) no interior de um tubo de cristal, que libertou um gás que denominou de «ar desflogisticado".[4] Com isso, observou que as velas ardiam mais intensamente no gás e que o rato estava mais ativo e vivia durante mais tempo enquanto o respirava. Após ele mesmo inalar o gás, escreveu: "A sensação do gás nos meus pulmões não era perceptivelmente diferente à do ar normal, mas senti o meu peito particularmente leve e desafogado durante algum tempo depois".[30] Priestley publicou as suas descobertas em 1775 num artigo intitulado "An Account of Further Discoveries in Air" ("Um relatório de mais descobertas no ar"), que incluiu no segundo volume do seu livro intitulado Experiments and Observation on Different Kinds of Air.[66][72] Uma vez que os seus achados foram publicados primeiro, Priestley é geralmente considerado o autor da descoberta.
O renomado químico francês Antoine Lavoisier afirmou mais tarde ter descoberto a substância autonomamente. No entanto, Priestley visitou Lavoisier em outubro de 1774 e falou-lhe sobre o seu experimento e como libertar o novo gás. Scheele também escreveu uma carta a Lavoisier em 30 de setembro do mesmo ano, na qual descrevia a sua própria descoberta da substância antes desconhecida, mas o francês nunca reconheceu tê-la recebido. Após a morte de Scheele, foi encontrada uma cópia da carta entre os seus pertences.[71]
Contribuição de Lavoisier

Embora tenha sido contestada na época, a contribuição de Lavoisier conduziu efectivamente às primeiras experiências quantitativas satisfatórias sobre a oxidação e forneceu a primeira explicação correta a respeito do funcionamento da combustão.[4] Estas e outras experimentações semelhantes, que tiveram início em 1774, iriam levar à desacreditação da teoria do flogisto e à comprovação de que a substância descoberta por Priestley e Scheele era um elemento químico.[70]
Numa experiência, Lavoisier observou que não havia um aumento da massa total quando o estanho e o ar eram aquecidos num recipiente fechado.[4] Notou que, quando o recipiente era aberto, o ar entrava subitamente nele, o que indicava que uma porção do ar retido teria sido consumido. Também observou que o estanho aumentara o seu peso e que o aumento era igual ao peso do ar que retornava para o recipiente quando aberto. Esta e outras experiências sobre a combustão foram documentas no seu livro Sur la combustion en général, publicado em 1777.[4] Nesta obra, provou que o ar é uma mistura de dois gases: o "ar essencial", fundamental para a combustão e respiração, e o azoto (do grego ἄζωτον, sem vida), que não servia para nenhuma das duas, o qual se viria mais tarde a denominar nitrogénio.[4]
Lavoisier renomeou o «ar essencial" como oxigénio em 1777, com base no grego ὀξύς (oxys) (ácido, literalmente "amargo", devido ao sabor dos ácidos) e -γενής (-genēs) (produtor, literalmente "que gera"), porque pensava, erroneamente, que o oxigénio era um constituinte de todos os ácidos.[9] Os químicos — em particular sir Humphry Davy, em 1812 — depois de um tempo comprovaram que Lavoisier estava errado na sua apreciação, pois, na realidade, é o hidrogénio que constitui a base química dos ácidos, entretanto o nome já se popularizara o suficiente para assim permanecer.[73]
Passado recente
A hipótese atómica original de John Dalton assumia que todos os elementos eram monoatómicos e que os átomos dos compostos teriam por norma as relações atômicas mais simples. Por exemplo, Dalton achava que a fórmula da água era HO, apresentando a massa atómica do oxigênio como 8 vezes a do hidrogénio, em vez de 16, o valor que lhe é atribuído hoje em dia.[74] Em 1805, Louis Joseph Gay-Lussac e Alexander von Humboldt mostraram que a água é formada por dois volumes de hidrogénio e um de oxigénio e, em 1811, Amedeo Avogadro chegou à correta interpretação sobre a composição do líquido, com base no que é hoje denominado de Lei de Avogadro e nas moléculas biatómicas elementares desses gases.[75]Predefinição:Efn
No final do século XIX, os pesquisadores deram conta de que o ar podia ser liquefeito e os seus componentes isolados por meio da compressão e arrefecimento. Utilizando um método de cascata, o químico e físico suíço Raoul Pictet evaporou dióxido de enxofre para liquefazer dióxido de carbono, que por sua vez era evaporado para arrefecer o oxigénio gasoso o suficiente para liquefazê-lo. Pictet enviou um telegrama à Academia de Ciências da França em 22 de dezembro de 1877 anunciando a sua descoberta do oxigénio líquido.[76] Apenas dois dias depois, o físico francês Louis Paul Cailletet anunciou o seu próprio método de liquefacção do oxigênio molecular.[76] Nos dois casos foram produzidas apenas algumas gotas do líquido, pelo que não foi possível realizar uma análise conclusiva. O oxigênio foi liquefeito de forma estável pela primeira vez a 29 de março de 1883 pelos cientistas polacos da Universidade Jaguelónica Zygmunt Wroblewski e Karol Olszewski.[77]
Em 1891, o químico escocês James Dewar conseguiu produzir uma quantidade suficiente de oxigênio líquido para poder estudá-lo. O primeiro processo comercialmente viável para a produção de oxigênio líquido foi desenvolvido em 1895 de forma independente pelos engenheiros Carl von Linde, alemão, e William Hampson, britânico. Ambos reduziram a temperatura do ar até que este se liquefizesse e, então, destilaram os componentes gasosos fazendo-os chegar à ebulição um a um e capturando-os. Mais tarde, em 1901, foi demonstrada pela primeira vez a soldadura de oxiacetileno ao queimar uma mistura de acetileno e O2 comprimido. Este método de soldagem e corte do metal veio mais tarde a tornar-se comum.[78] O físico William Thomson, em 1898, calculou que o oxigénio que permanece no planeta tem apenas cerca de 400 ou 500 anos, com base no ritmo de uso dos combustíveis fósseis na combustão.[79][80]
Em 1923, o cientista norte-americano Robert Goddard foi a primeira pessoa a desenvolver um motor de foguete, com uso de gasolina como combustível e oxigênio líquido como oxidante. Em 16 de março, conseguiu fazer voar um pequeno foguete propelido por combustível líquido ao longo de 56 m de altura a 97 km/h, em Auburn, Massachusetts.[78]
Acção biológica
Fotossíntese e respiração
O oxigénio respirado pelos organismos aeróbicos, liberado pelas plantas no processo de fotossíntese, participa na conversão de nutrientes em energia intracelular (ATP). O oxigénio molecular é o aceptor final de electrões da cadeia de transporte de electrões na respiração aeróbica celular. A redução dos níveis de oxigénio provoca hipoxemia, e a falta total dele ocasiona a anoxia, podendo provocar a morte do organismo.[81] Todas as espécies de cianobactérias que vivem hoje podem ser rastreadas até um ancestral comum que evoluiu há cerca de 2,9 bilhões de anos. Os ancestrais das cianobactérias se ramificaram de outras bactérias há cerca de 3,4 bilhões de anos, com a fotossíntese oxigenada provavelmente evoluindo durante meio bilhão de anos intermediários, no Éon Arqueano.[82]
De acordo com algumas estimativas, as algas verdes e as cianobactérias dos ambientes marinhos produzem cerca de 70% do oxigénio produzido na Terra, e as plantas terrestres são responsáveis pelo restante.[83] Outras estimativas apontam para uma contribuição oceânica na produção de oxigénio atmosférico ainda mais significativa, enquanto que outros estudos revelam números mais baixos, em torno dos 45% do oxigénio atmosférico total do planeta a cada ano.[84]
Uma fórmula genérica simplificada da fotossíntese é:[85]
A evolução fotolítica do oxigénio ocorre nas membranas dos tilacoides dos organismos fotossintéticos e requer energia de quatro fotões.Predefinição:Efn Estão implicados muitos processos, mas o resultado é a formação de um gradiente de protões através da membrana tilacoidal, que é usado para a sintetização de adenosina trifosfato (ATP) por meio da fotofosforilação. O O2 remanescente, após a oxidação e rutura da molécula de água, é liberado para a atmosfera.[86]Predefinição:Efn
O dioxigénio molecular é essencial para a respiração celular em todos os organismos aeróbios. O oxigénio é utilizado nas mitocôndrias para gerar adenosina trifosfato durante a fosforilação oxidativa. A equação para a respiração aeróbica é essencialmente o oposto da fotossíntese (embora o processo não seja exactamente o inverso, é muito diferente) e simplifica-se da seguinte forma:
Nos vertebrados, o O2 difunde-se através das membranas pulmonares para o interior dos glóbulos vermelhos. A hemoglobina liga-se ao O2 alterando a sua cor de um vermelho azulado para um vermelho brilhante[23] (o CO2 libera-se de outra parte da hemoglobina através do efeito de Bohr). Outros animais utilizam a hemocianina (moluscos e alguns artrópodes) ou hemeritrina (aranhas e lagostas).[39] Um litro de sangue pode dissolver 200 cm³ de O2.[39]
As espécies reactivas de oxigénio, como o ião superóxido (O2-) e peróxido de hidrogénio, são subprodutos perigosos no uso de oxigénio em organismos.[39] Algumas partes do sistema imunológico de organismos mais avançados, no entanto, criam peróxido, superóxido e oxigénio singlete para destruir micróbios invasores. As espécies reativas de oxigénio também apresentam um papel importante na resposta de hipersensibilidade das plantas contra o ataque de agentes patogénicos.[86]
Um ser humano adulto em repouso respira em média 13,5 vezes por minuto - 1,8 a 2,4 gramas de oxigénio por minuto.Predefinição:Efn A soma total da quantidade inalada por cada pessoa no planeta produz um total de 6 000 milhões de toneladas de oxigénio por ano.[87]
Organismos vivos
| Unidade | Pressão alveolar dos gases pulmonares |
Oxigénio do sangue arterial |
Gás sanguíneo venoso |
|---|---|---|---|
| kPa Predefinição:Efn | 14,2 | >11 | 4,0-5,3 |
| mmHg[88] | 107 | >79 | 30-40 |
O conteúdo de oxigénio livre expresso como pressão parcial no corpo dum organismo vertebrado vivo é normalmente maior no sistema respiratório e diminui ao longo de qualquer sistema arterial, tecidos periféricos e sistema venoso, respectivamente. A pressão parcial é a pressão que o oxigénio teria se ocupasse por si só o volume.[89]
Acumulação na atmosfera
O oxigénio gasoso não combinado era quase inexistente na atmosfera antes da evolução das bactérias e arqueas fotossintéticas. Surgiu pela primeira vez em quantidades significativas durante o éon Paleoproterozoico (entre 3000 e 2300 milhões de anos atrás).[90] Nos primeiros milhões de anos, o oxigénio combinou-se com ferro dissolvido nos oceanos para criar formações de ferro bandado. Os oceanos começaram a exalar oxigénio não combinado por volta de 3 000 e 2 700 milhões de anos, alcançando 10% do seu nível actual há cerca de 1 700 milhões de anos.[90][91]
A presença de grandes quantidades de oxigénio não combinado dissolvido nos oceanos e na atmosfera pode ter conduzido à extinção a maioria dos organismos anaeróbios que viviam na altura, durante a Grande oxidação (catástrofe do oxigénio) há cerca de 2 400 milhões de anos. Contudo, a utilização de O2 na respiração celular permite que os organismos aeróbios produzam muito mais ATP do que os anaeróbios, contribuindo para que os primeiros dominassem a biosfera da Terra.[92] A fotossíntese e respiração celular do O2 permitiram a evolução das células eucarióticas e, finalmente, o aparecimento de organismos multicelulares complexos como plantas e animais.
Desde o início do período Cambriano, há 540 milhões de anos, os níveis de O2 na atmosfera oscilaram entre 15% e 30% do volume.[93] Para fins do Carbonífero (há cerca de 300 milhões de anos) o nível de O2 na atmosfera atingiu um volume máximo de 35%,[93] o que pode ter contribuído para o desmesurado tamanho dos insetos e anfíbios daquela época.[94] As variações nos níveis de oxigénio ao longo da história foram alterando os diferentes climas. A diminuição dos níveis de oxigénio provocou uma queda na densidade da atmosfera, o que por sua vez aumentou a evaporação de água na superfície, dando lugar a um aumento de precipitações e temperaturas mais quentes.[95] A atividade humana, inclusive a combustão de 7 000 milhões de toneladas de combustível fóssil todos os anos, exerceu um impacto muito pequeno na quantidade de oxigénio combinado na atmosfera.[14] Com os níveis actuais da fotossíntese, demoraria cerca de 2 000 anos a regenerar a quantidade total de O2 na atmosfera atual.[96]
Produção industrial
São utilizados principalmente dois métodos para produzir 100 milhões de toneladas de O2 extraídas do ar para aplicações industriais a cada ano.[71] O mais comum consiste na destilação fracionada do ar liquefeito nos seus diversos componentes, com o N2 destilado como vapor e O2 deixado como líquido.[71]
O outro método principal de obtenção de O2 gasoso consiste em passar uma corrente de ar limpo e seco através de um leito de crivos moleculares de zeólito, que adsorvem o nitrogénio e deixam passar um fluxo de gás que é entre 90 e 93% de O2.[71] Simultaneamente, o outro leito de zeólito saturado de nitrogénio libera este gás ao reduzir a pressão de operação da câmara e introduzir nela, no sentido inverso do fluxo, parte do oxigénio separado no leito produtor. Depois de cada ciclo completo, os leitos são intercambiados, permitindo um fornecimento constante de oxigénio. Isto é conhecido por adsorção por oscilação de pressão e utiliza-se para produzir oxigénio em pequena escala.[97]
O oxigénio também pode ser produzido através da eletrólise da água, decompondo-a em oxigénio e hidrogénio, para o qual deve ser usada uma corrente contínua; se se usasse uma corrente alternada os gases de cada extremidade consistiriam em hidrogénio e oxigénio na explosiva relação de 2:1. Contrariamente à crença popular, a relação 2:1 observada na eletrólise de corrente contínua da água acidificada não demonstra que a fórmula empírica da água seja H2O, a menos que se assumam certas premissas sobre a fórmula molecular do hidrogénio e oxigénio. Um método semelhante é a evolução electrocatalítica do O2 de óxidos e oxiácidos. Também podem ser utilizados catalisadores químicos, como em geradores químicos de oxigénio ou nas velas de oxigénio usadas no equipamento de apoio em submarinos e que ainda são parte do equipamento padrão em companhias aéreas comerciais para situações de despressurização. Outra tecnologia de separação do ar consiste em forçar a dissolução do ar através de membranas de cerâmica com base em dióxido de zircónio, seja por alta pressão ou por corrente elétrica, para produzir O2 gasoso praticamente puro.[45]
Armazenamento
O custo da energia necessária para liquefazer o ar envolve o principal custo de produção, pelo que o preço da produção de oxigeno varia em função do preço da energia. Por motivos económicos, é costume transportar oxigénio em grandes quantidades em estado líquido, armazenado em tanques especialmente isolados, uma vez que um litro de oxigénio líquido equivale a 840 litros de oxigénio gasoso à pressão atmosférica e 20 °C (68 °F).[71] Estas cisternas são usadas para encher os grandes contentores de oxigénio líquido que se encontram no exterior dos hospitais e demais instituições que necessitam de enormes quantidades de oxigénio gasoso puro. O oxigénio líquido é passado por uns permutadores de calor que convertem o líquido criogénico em gás antes de entrar no edifício. O oxigénio também é armazenado e transportado em cilindros que contêm o gás comprimido, sendo muito útil para determinadas aplicações médicas portáteis e oxicorte.[71]
Aplicações
Medicina
O propósito essencial da respiração consiste na absorção de O2 do ar e, em medicina, são utilizados suplementos de oxigénio. O tratamento não só aumenta os níveis de oxigénio no sangue do paciente, como também apresenta um efeito secundário de diminuir a resistência ao fluxo sanguíneo em muitos tipos de pulmões doentes, facilitando o trabalho de bombeamento do coração. A oxigenoterapia é utilizada para tratar o enfisema, a pneumonia, determinadas insuficiências cardíacas, certas desordens que causam uma elevada pressão arterial pulmonar e qualquer doença que afecte a capacidade do corpo para absorver e usar oxigénio gasoso.[98]
Os tratamentos são suficientemente flexíveis para ser usados em hospitais, na casa do paciente ou, cada vez mais comum, por meio de dispositivos portáteis. Assim, as tendas de oxigénio eram antes empregues como suplementos de oxigénio, mas foram substituídas pelas máscaras de oxigénio e cânulas nasais.[99]
A medicina hiperbárica (de alta pressão) utiliza câmaras especiais de oxigénio para aumentar a pressão parcial do O2 no paciente e, quando necessário, no pessoal médico.[100] A intoxicação por monóxido de carbono, a mionecrose (gangrena gasosa) e a síndrome de descompressão são por vezes tratadas com recurso a estes aparelhos.[101] O aumento da concentração de O2 nos pulmões ajuda a deslocar o monóxido de carbono do hemogrupo da hemoglobina.[102][103] O oxigénio é tóxico para a bactéria anaeróbica que provoca gangrena gasosa, de forma que aumentar a sua pressão parcial ajuda a acabar com elas.[104][105] A síndrome de descompressão ocorre em mergulhadores que saem demasiado rápido do mar, o que resulta na formação de bolhas de gás inerte no seu sangue, sobretudo de nitrogénio.[98][106][107]
O oxigénio é também utilizado clinicamente em pacientes que necessitam de ventilação mecânica, normalmente a concentrações superiores a 21% encontradas no ar ambiente. Para além disto, o isótopo 15O foi usado de forma experimental na tomografia por emissão de positrões.[108]
Suporte vital e uso recreativo

Uma aplicação notável do O2 como gás respirável de baixa pressão encontra-se nos trajes espaciais modernos, que envolvem o corpo dos seus ocupantes com ar pressurizado. Estes dispositivos usam oxigénio quase puro a uma pressão de cerca de um terço da normal, resultando numa pressão parcial normal de O2 no sangue. Este intercâmbio de oxigénio de alta concentração para uma baixa pressão é necessária para manter a flexibilidade dos fatos espaciais.[109][110]
Os mergulhadores e os tripulantes de submarinos também utilizam O2 fornecido artificialmente, mas a maioria usa uma pressão normal ou uma mistura de oxigénio e ar. O uso de O2 puro ou quase puro em mergulho a pressões maiores que a atmosférica geralmente restringe-se a intervalos de descanso, descompressão e tratamentos de emergência a relativamente pouca profundidade (~ 6 metros ou menos). O mergulho a uma profundidade mais elevada requer uma diluição significativa de O2 com outros gases, como nitrogénio ou hélio, para ajudar a prevenir a toxicidade do oxigénio.[111][112]
Os alpinistas e os que viajam em aviões não pressurizados normalmente têm um suplemento de O2.Predefinição:Efn Os passageiros de aviões comerciais (pressurizados) possuem um fornecimento de O2 para situações de emergência, que é colocado automaticamente à sua disposição em caso de despressurização da cabine. Uma perda repentina de pressão na cabine ativa os geradores químicos de oxigénio em cada assento, pondo à disposição as máscaras de oxigénio. Assim que as máscaras caem, elas ficam presas por um cabo de acionamento. Quando a máscara é puxada, esse cabo aciona o gatilho do gerador de oxigénio, provocando uma reação exotérmica entre limalha de ferro e sal clorato de sódio, contidos no recipiente armazenador. O calor liberado aquece ainda mais o clorato restante, que se decompõe rapidamente, liberando oxigénio.[45]
O oxigénio, que provoca uma suave resposta de euforia quando inalado, tem toda uma história de uso recreativo em desportos e bares de oxigénio. Estes estabelecimentos apareceram no Japão, Califórnia e Las Vegas no final dos anos 1990, e oferecem exposições a níveis de O2 superiores ao normal em troca de uma determinada tarifa.[113] Aos atletas profissionais, especialmente em futebol americano, em algumas ocasiões, quando saem do campo durante os intervalos, é-lhes colocada uma máscara de oxigénio com o propósito de aumentar o seu desempenho no jogo. O efeito farmacológico é contudo duvidoso, sendo que a explicação mais viável a haver está normalmente associada ao efeito placebo.[113] Existem estudos que sustentam essa eventual estimulação e aumento do desempenho físico com misturas de O2 enriquecido, mas só quando inalado durante o exercício aeróbico.[114]
Indústria
A fundição de minério de ferro na produção de aço consome 55% do oxigénio produzido comercialmente. Neste processo, o O2 é injetado com uma lança de alta pressão no ferro fundido, que remove as impurezas de enxofre e o excesso de carbono, na forma dos seus respectivos óxidos, SO2 e CO2. As reações são exotérmicas e a temperatura aumenta até aos 1700 Cº.[45]
Outros 25% deste oxigénio são utilizados pela indústria química. O etileno reage com o O2 para criar óxido de etileno, que, por sua vez, converte-se em etilenoglicol, o material usado como base para a fabricação de uma grande variedade de produtos, incluindo anticongelantes e polímeros de poliéster (os precursores de muitos plástico e têxteis).[45]
Os restantes 20% são em grande parte utilizados em aplicações medicinais, oxicorte, como oxidante em combustível de foguetes e no tratamento de águas.[45] O oxigénio é usado em soldadura oxiacetilénica queimando acetileno com O2 para produzir uma chama bastante quente. Neste processo, o metal, que pode ter até 60 centímetros de espessura, é aquecido primeiro com uma pequena chama de oxiacetileno para depois ser rapidamente cortado por um enorme jato de O2.[115]
Investigação

Os paleoclimatólogos medem a relação entre o oxigénio-18 e o oxigénio-16 nos esqueletos e exoesqueletos dos organismos marinhos para determinar como era o clima há milhões de anos. As moléculas de água do mar que contêm o isótopo mais leve, o oxigénio-16, evaporam-se a um ritmo ligeiramente maior do que as moléculas que contêm oxigénio-18 (cerca de 12% mais pesado); esta disparidade aumenta a baixas temperaturas.[116] Em períodos com uma temperatura global mais baixa, a neve e a chuva procedentes dessa água evaporada tendem a ser mais ricas em oxigénio-16, enquanto que a água do mar deixada para trás tende a ser mais rica em oxigénio-18. Os organismos marinhos, portanto, incorporam mais oxigénio-18 nos seus esqueletos e exoesqueletos do que o fariam num ambiente mais quente. Os paleoclimatólogos também medem diretamente esta relação nas moléculas de água de amostras de núcleos de gelo que se conservaram durante várias centenas de milhares de anos.[116]
Os geólogos planetários mediram as diferenças na abundância de isótopos de oxigénio em amostras da Terra, Lua, Marte e meteoritos, mas não foram capazes de obter valores de referência para as relações entre isótopos do Sol, que se acredita serem iguais às da nebulosa protossolar. No entanto, a análise duma bolacha de silício exposta ao vento solar no espaço e devolvida à Terra pela sonda Genesis revelou que o Sol possui uma proporção de oxigénio-16 maior do que o nosso planeta. A medição permite-nos inferir que um processo desconhecido esgotou o oxigénio-16 do disco protoplanetário do Sol antes da fusão dos grãos de poeira que formaram a Terra.[117]
O oxigénio apresenta duas bandas de absorção espectrofotométrica com máximos em comprimentos de onda de 687 e 760 nanómetros. Alguns cientistas de deteção remota propuseram usar a medição da radiação proveniente dos dosseis de vegetação nessas bandas para caracterizar a saúde das plantas a partir de uma plataforma satélite. Esta aproximação explora o fato de que nessas bandas é possível distinguir a reflectividade da vegetação da sua fluorescência, que é muito mais fraca. A medição é tecnicamente difícil de se fazer devido à baixa relação sinal-ruído e à estrutura física da vegetação, mas tem sido encarada como um possível método de monitorização do ciclo do carbono a partir de satélites à escala global.[118]
Segurança e precauções
Toxicidade

O oxigénio gasoso pode ser tóxico a pressões parciais elevadas, produzindo convulsões e outros problemas de saúde.[111]Predefinição:Efn[120] A toxicidade geralmente começa a aparecer com pressões parciais de mais de 50 kPa ou 2,5 vezes a pressão parcial do O2 ao nível do mar (21 kPa; igual a cerca de 50% da composição do oxigénio sob pressão normal). Isto não é um problema, excepto para os doentes com ventilação mecânica, porque o gás administrado através das máscaras de oxigénio é tipicamente composto por apenas 30%-50% de O2 por volume (cerca de 30 kPa na pressão normal), embora estes números variem significativamente dependendo do tipo de máscara.[30]
No passado, os bebés prematuros eram colocados em incubadoras que continham ar rico em O2, mas esta prática foi descontinuada depois de algumas destas crianças terem perdido a visão.[30][121]
A respiração de O2 puro em aplicativos espaciais, como nalguns trajes aeroespaciais modernos ou em naves pioneiras como a Apollo, não é prejudicial devido às baixas pressões totais utilizadas. No caso dos fatos, a pressão parcial do O2 no gás respiratório encontra-se, geralmente, cerca de 30 kPa (1,4 vez o normal) e a pressão parcial resultante no sangue arterial do astronauta é apenas ligeiramente maior do que a pressão normal ao nível do mar.[109][122] (para mais informações vide traje espacial e gasometria arterial).
A toxicidade do oxigénio para os pulmões e sistema nervoso central também pode ocorrer no mergulho profundo e no mergulho profissional.[30][111] A respiração prolongada duma mistura de ar com uma pressão parcial de O2 superior a 60 kPa pode dar origem a uma fibrose pulmonar permanente.[123]
A exposição a pressões parciais superiores a 160 kPa (~ 1,6 atmosfera) pode causar convulsões, normalmente fatais para os mergulhadores. A toxicidade aguda pode ser produzida ao respirar uma mistura de ar com mais de 21% de O2 a 66 ou mais metros de profundidade; o mesmo pode acontecer ao respirar 100% de O2 a apenas 6 metros.[123][124][125][126]
Combustão e outros riscos

As fontes ricas em oxigénio na presença de materiais combustíveis são altamente susceptíveis de provocar a rápida combustão. Os riscos de fogo e explosão dão-se quando os oxidantes concentrados e os combustíveis estão demasiado próximos; no entanto, a ignição, seja pelo calor ou por uma faísca, é necessária para desencadear a combustão.[21][127] O mesmo acontece se as fontes de oxigénio forem cloratos, percloratos, dicromatos etc.; estes compostos com alto poder oxidante podem provocar também queimaduras químicas. O oxigénio por si só não é um combustível, mas um oxidante. Os riscos de combustão também se aplicam a compostos de oxigénio de alto potencial oxidante, como os peróxidos, cloratos, nitratos, percloratos e dicromatos, porque podem doar oxigénio ao fogo.[21][22]
O O2 concentrado permite uma combustão rápida e enérgica.[127] Os tubos e os recipientes de aço usados para armazenar e transportar tanto o oxigénio líquido como o gasoso actuam como combustível; à vista disso, o desenho e fabricação dos sistemas de O2 requerem uma atenção especial para assegurar que as fontes de ignição sejam minimizadas.[127] O incêndio que acabou com a vida da tripulação do Apollo 1 em 1967 num ensaio na plataforma de lançamento alastrou-se tão rapidamente porque a cápsula estava pressurizada com O2 puro, mas a uma pressão ligeiramente maior do que a pressão atmosférica, em vez duma pressão de 1/3 da normal que deveria ter sido usada na missão.Predefinição:Efn[128]
No caso dum derrame de oxigénio líquido, se este for embebido em matéria orgânica como madeira, produtos petroquímicos e asfalto estes materiais podem detonar imprevisivelmente ao sofrer um subsequente impacto mecânico. Tal como acontece com outros líquidos criogénicos, em contacto com o corpo humano pode provocar o congelamento da pele e dos olhos.[127]
Notas
Predefinição:Refbegin Predefinição:Notelist Predefinição:Refend
Referências
- ↑ «WebElements: the periodic table on the web – Oxygen: electronegativities». p. WebElements. Consultado em 7 de novembro de 2011
- ↑ 2,0 2,1 Predefinição:Harvnb
- ↑ 3,0 3,1 «Oxygen». Los Alamos National Laboratory. Consultado em 22 de julho de 2012. Arquivado do original em 26 de outubro de 2007
- ↑ 4,0 4,1 4,2 4,3 4,4 4,5 4,6 4,7 4,8 Predefinição:Harvnb
- ↑ «Atmospheric Oxygen Research». Scrippdios Institute. Consultado em 20 de abril de 2016
- ↑ «Lox/LH2». Encyclopedia Astronautica. Consultado em 22 de setembro de 2015
- ↑ NASA, ed. (27 de setembro de 2007). «NASA Research Indicates Oxygen on Earth 2.5 Billion Years ago» (em English). Consultado em 22 de julho de 2012
- ↑ «Atomic oxygen erosion». Consultado em 8 de agosto de 2009. Arquivado do original em 13 de junho de 2007
- ↑ 9,0 9,1 9,2 9,3 Predefinição:Harvnb
- ↑ «Molecular Orbital Theory». Purdue University. Consultado em 24 de agosto de 2014. Arquivado do original em 10 de maio de 2008
- ↑ Predefinição:Harvnb
- ↑ 12,0 12,1 Jakubowski, Henry. «Chapter 8: Oxidation-Phosphorylation, the Chemistry of Di-Oxygen». Saint John's University. p. Biochemistry Online. Consultado em 28 de janeiro de 2008
- ↑ Predefinição:Harvnb
- ↑ 14,0 14,1 Predefinição:Harvnb
- ↑ «Demonstration of a bridge of liquid oxygen supported against its own weight between the poles of a powerful magnet». University of Wisconsin-Madison Chemistry Department Demonstration lab. Consultado em 22 de julho de 2012. Arquivado do original em 17 de dezembro de 2007
- ↑ Predefinição:Harvnb
- ↑ Predefinição:Harvnb
- ↑ Predefinição:Harvnb
- ↑ Predefinição:Harvnb
- ↑ Chieh, Chung. «Bond Lengths and Energies». p. University of Waterloo. Consultado em 11 de outubro de 2014. Arquivado do original em 14 de dezembro de 2007
- ↑ 21,0 21,1 21,2 Predefinição:Harvnb
- ↑ 22,0 22,1 Predefinição:Harvnb
- ↑ 23,0 23,1 23,2 Predefinição:Harvnb
- ↑ 24,0 24,1 Predefinição:Harvnb
- ↑ 25,0 25,1 Phillip, Ball (16 de setembro de 2001). «New form of oxygen found». Nature News. Consultado em 22 de julho de 2012. Arquivado do original em 8 de agosto de 2007
- ↑ Predefinição:Harvnb
- ↑ Predefinição:Harvnb
- ↑ Predefinição:Harvnb
- ↑ «World Ocean Atlas 2009». National Centers for Environmental Information. Consultado em 26 de abril de 2016
- ↑ 30,0 30,1 30,2 30,3 30,4 30,5 Predefinição:Harvnb
- ↑ 31,0 31,1 «Air solubility in water». p. The Engineering Toolbox. Consultado em 26 de outubro de 2014
- ↑ Predefinição:Harvnb
- ↑ Predefinição:Harvnb
- ↑ «Overview of Cryogenic Air Separation and Liquefier Systems». Universal Industrial Gases, Inc. Consultado em 15 de janeiro de 2015
- ↑ «Liquid Oxygen Material Safety Data Sheet» (PDF). p. Matheson Tri Gas. Consultado em 15 de janeiro de 2015
- ↑ Predefinição:Harvnb
- ↑ Predefinição:Harvnb
- ↑ Predefinição:Harvnb
- ↑ 39,0 39,1 39,2 39,3 Predefinição:Harvnb
- ↑ Predefinição:Harvnb
- ↑ Predefinição:Harvnb
- ↑ Predefinição:Harvnb
- ↑ Predefinição:Harvnb
- ↑ Predefinição:Harvnb
- ↑ 45,0 45,1 45,2 45,3 45,4 45,5 Predefinição:Harvnb
- ↑ 46,0 46,1 46,2 46,3 «Oxygen Nuclides / Isotopes». p. EnvironmentalChemistry.com. Consultado em 15 de janeiro de 2015
- ↑ 47,0 47,1 47,2 Meyer, B.S. (21 de setembro de 2005). «Nucleosynthesis and Galactic Chemical Evolution of the Isotopes of Oxygen». Gatlinburg, Tennessee: Workshop on Oxygen in the Earliest Solar System. Proceedings of the NASA Cosmochemistry Program and the Lunar and Planetary Institute. 9022
- ↑ «NUDAT 13O». Consultado em 22 de julho de 2012
- ↑ «NUDAT 14O». Consultado em 21 de fevereiro de 2015
- ↑ «NUDAT 15O». Consultado em 21 de fevereiro de 2015
- ↑ Predefinição:Harvnb
- ↑ TMH.
- ↑ Predefinição:Harvnb
- ↑ Chaplin, Martin (4 de janeiro de 2008). «Water Hydrogen Bonding». Consultado em 27 de junho de 2015
- ↑ Predefinição:Harvnb
- ↑ 56,0 56,1 Predefinição:Harvnb
- ↑ Predefinição:Harvnb
- ↑ Predefinição:Harvnb
- ↑ Predefinição:Harvnb
- ↑ Predefinição:Harvnb
- ↑ Predefinição:Harvnb
- ↑ Predefinição:Harvnb
- ↑ Predefinição:Harvnb
- ↑ Predefinição:Harvnb
- ↑ Predefinição:Harvnb
- ↑ 66,0 66,1 66,2 66,3 66,4 Cook & Lauer 1968, p.499.
- ↑ 67,0 67,1 67,2 Britannica contributors (1911). «John Mayow». Encyclopædia Britannica 11ª ed. [S.l.: s.n.] Consultado em 16 de dezembro de 2007. Arquivado do original em 25 de agosto de 2013
- ↑ 68,0 68,1 World of Chemistry contributors (2005). «John Mayow». World of Chemistry. [S.l.]: Thomson Gale. ISBN 0669327271. Consultado em 16 de dezembro de 2007
- ↑ 69,0 69,1 Predefinição:Harvnb
- ↑ 70,0 70,1 Predefinição:Harvnb
- ↑ 71,0 71,1 71,2 71,3 71,4 71,5 71,6 Predefinição:Harvnb
- ↑ Predefinição:Harvnb
- ↑ Predefinição:Harvnb
- ↑ Predefinição:Harvnb
- ↑ Predefinição:Harvnb
- ↑ 76,0 76,1 Predefinição:Harvnb
- ↑ «Poland – Culture, Science and Media. Condensation of oxygen and nitrogen». 4 de outubro de 2008. Arquivado do original em 4 de outubro de 2010
- ↑ 78,0 78,1 «Goddard-1926». NASA. Consultado em 18 de novembro de 2007. Arquivado do original em 6 de novembro de 2015
- ↑ «Papers Past – Evening Post – 30 de julho de 1898 – A Startling Scientific Prediction». Paperspast.natlib.govt.nz. Consultado em 7 de novembro de 2011
- ↑ «The Oxygen Famine». The Evening News. 16 de julho de 1901. Consultado em 20 de junho de 2015
- ↑ Predefinição:Harvnb
- ↑ Chu, Jennifer; Technology, Massachusetts Institute of (30 de setembro de 2021). «MIT Scientists Zero In on the Origins of Earth's "Single Most Important Evolutionary Innovation"». SciTechDaily (em English). Consultado em 1 de outubro de 2021
- ↑ Predefinição:Harvnb
- ↑ Predefinição:Harvnb
- ↑ Predefinição:Harvnb
- ↑ 86,0 86,1 Predefinição:Harvnb
- ↑ (1,8 gramas/min/pessoa)×(60 min/h)×(24 h/dia)×(365 dias/ano)×(6600 milhões de pessoas)/1 000 000 g/t=6240 milhões de toneladas.
- ↑ «ABG (Arterial Blood Gas)». p. brooksidepress.org. Consultado em 21 de abril de 2016
- ↑ Predefinição:Harvnb
- ↑ 90,0 90,1 Predefinição:Harvnb
- ↑ Predefinição:Harvnb
- ↑ Predefinição:Harvnb
- ↑ 93,0 93,1 Predefinição:Harvnb
- ↑ Predefinição:Harvnb
- ↑ Predefinição:Harvnb
- ↑ Predefinição:Harvnb
- ↑ «Non-Cryogenic Air Separation Processes». 2003. p. UIG Inc. Consultado em 22 de julho de 2012
- ↑ 98,0 98,1 Predefinição:Harvnb
- ↑ Predefinição:Harvnb
- ↑ Predefinição:Harvnb
- ↑ «Indications for hyperbaric oxygen therapy». p. Undersea and Hyperbaric Medical Society. Consultado em 20 de junho de 2015. Arquivado do original em 25 de maio de 2011
- ↑ «Carbon Monoxide». p. Undersea and Hyperbaric Medical Society. Consultado em 22 de julho de 2012. Arquivado do original em 25 de julho de 2008
- ↑ Predefinição:Harvnb
- ↑ Predefinição:Harvnb
- ↑ Predefinição:Harvnb
- ↑ «Decompression Sickness or Illness and Arterial Gas Embolism». p. Undersea and Hyperbaric Medical Society. Consultado em 22 de julho de 2012. Arquivado do original em 5 de julho de 2008
- ↑ Predefinição:Harvnb
- ↑ Predefinição:Harvnb
- ↑ 109,0 109,1 Predefinição:Harvnb
- ↑ Predefinição:Harvnb
- ↑ 111,0 111,1 111,2 Predefinição:Harvnb
- ↑ Predefinição:Harvnb
- ↑ 113,0 113,1 Bren, Linda (2002). «Oxygen Bars: Is a Breath of Fresh Air Worth It». U.S. Food and Drug Administration. p. FDA Consumer magazine. Consultado em 22 de julho de 2012. Arquivado do original em 18 de outubro de 2007
- ↑ «Ergogenic Aids». p. Peak Performance Online. Consultado em 22 de julho de 2012. Arquivado do original em 28 de setembro de 2007
- ↑ Predefinição:Harvnb
- ↑ 116,0 116,1 Predefinição:Harvnb
- ↑ Predefinição:Harvnb
- ↑ Predefinição:Harvnb
- ↑ Predefinição:Harvnb
- ↑ Predefinição:Harvnb
- ↑ Predefinição:Harvnb
- ↑ Wade, Mark (2007). «Space Suits». p. Encyclopedia Astronautica. Consultado em 28 de junho de 2015. Arquivado do original em 13 de dezembro de 2007
- ↑ 123,0 123,1 Predefinição:Harvnb
- ↑ Predefinição:Harvnb
- ↑ Predefinição:Harvnb
- ↑ Predefinição:Harvnb
- ↑ 127,0 127,1 127,2 127,3 Predefinição:Harvnb
- ↑ Predefinição:Harvnb
Predefinição:Bibliografia sobre o Oxigénio
Ligações externas
- «Enciclopedia Libre - Oxígeno» (em español)
- «Los Alamos National Laboratory - Oxygen» (em English)
- «WebElements.com - Oxygen» (em English)
- «EnvironmentalChemistry.com - Oxygen» (em English)
- «It's Elemental - Oxygen» (em English)
- «Oxygen Therapy - The First 150 Years» (em English)
- «Oxigênio - TabelaPeriódica.Org» (em português)













 " class="attachment-atbs-s-4_3 size-atbs-s-4_3 wp-post-image" alt="O que estudar para o enem 2023">
" class="attachment-atbs-s-4_3 size-atbs-s-4_3 wp-post-image" alt="O que estudar para o enem 2023"> " class="attachment-atbs-s-4_3 size-atbs-s-4_3 wp-post-image" alt="Qual melhor curso para fazer em 2023">
" class="attachment-atbs-s-4_3 size-atbs-s-4_3 wp-post-image" alt="Qual melhor curso para fazer em 2023"> " class="attachment-atbs-s-4_3 size-atbs-s-4_3 wp-post-image" alt="Enem: Conteúdos E Aulas On-Line São Opção Para Os Estudantes">
" class="attachment-atbs-s-4_3 size-atbs-s-4_3 wp-post-image" alt="Enem: Conteúdos E Aulas On-Line São Opção Para Os Estudantes"> " class="attachment-atbs-s-4_3 size-atbs-s-4_3 wp-post-image" alt="Como Fazer Uma Carta De Apresentação">
" class="attachment-atbs-s-4_3 size-atbs-s-4_3 wp-post-image" alt="Como Fazer Uma Carta De Apresentação"> " class="attachment-atbs-s-4_3 size-atbs-s-4_3 wp-post-image" alt="Como Escrever Uma Boa Redação">
" class="attachment-atbs-s-4_3 size-atbs-s-4_3 wp-post-image" alt="Como Escrever Uma Boa Redação"> " class="attachment-atbs-s-4_3 size-atbs-s-4_3 wp-post-image" alt="Concurso INSS edital 2022 publicado">
" class="attachment-atbs-s-4_3 size-atbs-s-4_3 wp-post-image" alt="Concurso INSS edital 2022 publicado">


