Em química, a teoria dos orbitais moleculares (TOM) explica as ligações covalentes. Um OM é uma função matemática que descreve tendências a um comportamento de uma nuvem eletrônica em uma molécula.[1] Químicos usam estas funções para predizer ou explicar propriedades químicas e físicas de materiais. Por exemplo, as funções podem dizer a probabilidade de se encontrar um elétron em qualquer região específica. Químicos costumam construir modelos matemáticos de orbitais moleculares combinando orbitais atômicos. Orbitais híbridos de cada átomo de uma molécula, ou de outros orbitais moleculares de outros grupos de átomos também podem ser usados. Computadores podem manipular estas funções. Orbitais moleculares permitem aos químicos a aplicação de mecânica quântica para estudar moléculas. Orbitais moleculares respondem questões sobre como os átomos prendem-se uns aos outros em uma molécula.[2][3]
A teoria
A teoria das orbitais moleculares (TOM) considera a sobreposição de orbitais de valência e não elétrons emparelhados, diferentemente da TLV( Teoria da ligação de valência)que usa conceitos de sobreposição de nuvens eletrônicas.[1][2][3][4]
Quando um átomo se aproxima de outro, dois orbitais , dois orbitais segundo o eixo da ligação, ou um orbital e uma orbital podem se combinar, formando uma orbital molecular .[5]
Quando os orbitais combinados não estão segundo o eixo da ligação, mas estão posicionados de modo a possibilitar um superposição positiva, forma-se uma .
Há, ainda, casos em que, ou por motivos de simetria ou por grande diferença de níveis energéticos, os orbitais atômicos que superpõem dão origem a OM não ligantes.
Então, a principal diferença entre a TOM e a TLV é o conceito de orbital molecular, que define uma região do espaço que pode ser ocupada por dois elétrons com spins emparelhados.
História
A teoria dos orbitais moleculares foi desenvolvida, nos anos após o estabelecimento da teoria de valência, primariamente através de esforços de Friedrich Hund, Robert Mulliken, John C. Slater e John Lennard-Jones, por isso esta teoria foi inicialmente chamada de teoria Hund-Mulliken. A palavra "orbital" foi introduzida por Mulliken em 1932. Em 1933, a teoria foi aceita pela comunidade científica. O primeiro cálculo acuraz de uma função de onda de orbital molecular foi feito por Charles Coulson em 1938 em uma molécula de hidrogênio. Em 1950, orbitais moleculares foram completamente definidos como polinômios característicos (funções de onda) do auto-consistente campo Hamiltoniano e foi nesse ponto que a teoria se tornou uma teoria completamente consistente e rigorosa. Tal aproximação rigorosa é conhecida como Método de Hartree-Fock para moléculas, apesar do método ter sido, originalmente, em cálculos para átomos. Em cálculos sobre moléculas, os orbitais moleculares foram expandidos em termos da configuração básica de um orbital atômico, levando às equações de Roothaan, o que por sua vez levou ao desenvolvimento de muito métodos ao início. Em paralelo, a teoria dos orbitais moleculares foi aplicada de uma maneira mais aproximada usando alguns parâmetros empiricamente derivados em métodos hoje conhecidos como métodos quânticos semiempíricos.[6][7]
Visão geral

A teoria dos orbitais moleculares usa uma combinação linear de orbitais atômicos para representar orbitais moleculares envolvendo toda a molécula. Estes são frequentemente divididos em orbitais ligantes, anti-ligantes e não-ligantes. Um orbital molecular é meramente um orbital de Schrödinger que inclui alguns, geralmente dois, núcleos atômicos. Se este orbital é do tipo no qual elétrons têm maior probabilidade de ficar entre os núcleos que em outros lugares, então ele é do tipo ligante, este tipo de orbital tende à manter os núcleos interligados. Se os elétrons tendem a ficar em um orbital no qual a probabilidade deles gastarem mais tempo em posições fora da região internuclear, o orbital funcionará como anti-ligante e enfraquecerá a ligação. Elétrons em orbitais não-ligantes tendem a ficar em orbitais profundos - próximos do núcleo - quase que totalmente associados à um dos núcleos, ou então têm mesma probabilidade de estar ou não entre os núcleos. Tais elétrons não afetam significativamente a força da ligação.[1][2][3]
Orbitais moleculares são divididos de acordo com os tipos de combinação de orbitais atômicos para formar a ligação. Estes orbitais são resultado das interações núcleo-elétron que são causadas pela força eletromagnética. Elementos químicos formarão ligação se seus orbitais moleculares apresentarem menor energia quando juntos. Ligações químicas diferentes são distinguidas pela configuração eletrônica (formato da nuvem eletrônica) e por níveis de energia.
A teoria dos orbitais moleculares provê uma perspectiva global e deslocalizada de uma ligação química. Na TOM, qualquer elétron em uma molécula pode ser encontrado em qualquer posição na molécula, já que condições quânticas permitem a passagem de elétrons sobre a influência de um número arbitrariamente grande de núcleos, desde que, tal posição, seja permitida por certas regras da quântica. Apesar de, na TOM, alguns orbitais moleculares manterem elétrons que tendem a estar localizados entre um par específico de núcleos, outros podem permitir um distribuição mais uniforme dos elétrons na molécula. Portanto, de maneira geral, a ligação é muito mais deslocalizada na TOM que na implícita da Teoria da ligação de valência. Isso faz da TOM mais útil para a descrição de sistemas extensos.[8]
Ligações em orbitais moleculares
Degenerescência orbital
Orbitais moleculares são ditos ser degenerado, se tiverem a mesma energia. Por exemplo, nas moléculas diatômicas homonucleares dos primeiros dez elementos químicos, os orbitais moleculares derivadas do e os orbitais atômicos resulta em dois orbitais degenerados de ligação (de baixa energia) e dois orbitais anti-ligante degenerados (de alta energia).[5]
Ligações Iônicas
Quando a diferença de energia entre os orbitais atômicos de dois átomos é muito grande, um orbital atômico contribui quase inteiramente aos orbitais de ligação, e outros orbitais atômico contribuem quase inteiramente para os orbitais anti-ligante. Assim, a situação é efetiva para que alguns electrões sejam transferidos de um átomo para outro. Isso é chamado de ligação iônica.
Ordem de ligação
A ordem de ligação, ou o número de ligações, de uma molécula pode ser determinada através da combinação do número de electrões na ligação e orbitais moleculares anti-ligante. Um par de elétrons num orbital de ligação cria uma ligação, enquanto um par de elétrons em um orbital anti-ligante nega uma ligação. Por exemplo, , com oito elétrons no orbital de ligação e dois elétrons no orbital anti-ligante, tem uma ordem de ligação de três, o que constitui uma ligação tripla.
A força de ligação é proporcional à ordem de ligação -a maior quantidade de ligação produz uma ligação mais estável - e a força de ligação é inversamente proporcional a ela -uma ligação mais forte é mais curto.
Há raras exceções ao requisito de molécula com uma ordem de ligação positiva. Embora tem uma ordem de ligação de acordo com a análise , existem evidências experimentais de uma molécula de é altamente instável, tendo um comprimento de ligação de 245 pm e energia de ligação de 10 kJ/mol.[5]
HOMO e LUMO
O mais alto molecular orbital ocupado e o menor desocupado são muitas vezes referida como o HOMO e LUMO, respectivamente. A diferença de energias do HOMO e LUMO, denominado o intervalo de banda, por vezes, pode servir como uma medida de excitabilidade da molécula: Quanto menor for a energia, mais facilmente ela vai ser excitada.
Exemplo
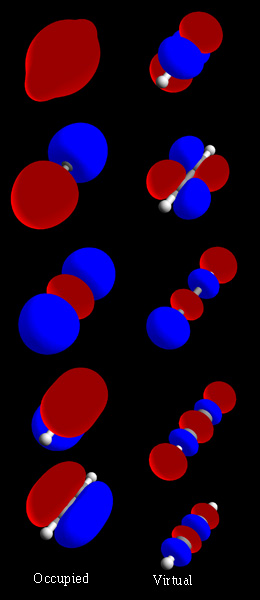
Hidrogênio
Ao formar estas orbitais moleculares, as orbitais atômicas podem sobrepor-se por interferência construtiva ou destrutiva. No primeiro caso, as intensidades das ondas adicionam-se, enquanto que no segundo, subtraem-se.[1][3]
As orbitais moleculares em que a interferência é construtiva denominam-se orbitais moleculares ligantes, e contribuem para a aproximação dos núcleos, aumentando sua estabilidade.
As orbitais moleculares em que a interferência é destrutiva denominam-se orbitais moleculares antiligantes, e contribuem para o afastamento dos núcleos e também o orbital molecular não-ligante onde a interação não é efetiva.
Algumas moléculas Orgânicas
A descrição, através da TOM, do benzeno, que é composto de um anel hexagonal de seis átomos de carbono. Nesta molécula, 24 dos 30 elétrons ligantes de valência estão localizados em 12 orbitais (sigma) ligantes, que estão localizados, predominantemente, entre os pares de átomos ( ou ), similarmente à descrição fornecida pela Teoria da ligação de valência. Entretanto, no benzeno, os outros seis elétrons ligantes estão localizados em três orbitais (pi) ligantes que permanecem deslocalizados ao redor do anel. Dois destes elétrons estão em um orbital molecular que que têm iguais contribuições de todos os átomos de carbono. Os outros quatro estão em orbitais com nodos verticais que fazem ângulos retos entre si. Como na TLV, todos esses seis elétrons deslocalizados (em ) residem em um grande espaço sob e sobre o plano do anel. Todas as ligações carbono-carbono no benzeno são quimicamente equivalentes. Na TOM isto é uma consequência direta do fato de três orbitais combinam-se e espalham os seis elétrons extra sobre os seis átomos de carbono.[1][2][3][9]
Em moléculas como o metano, os oito elétrons de valência são encontrados em quatro orbitais moleculares que estão espalhados exteriormente à todos os átomos. Porém, é possível aproximar tais OM com quatro orbitais localizados similares, em forma, aos orbitais híbridos preditos pela Teoria da ligação valente. Isto é frequentemente adequado para ligações , mas não é possível para para orbitais . A descrição de um OM deslocalizado é mais apropriada para ionização e predições espectroscópicas. Quando o metano é ionizado, um elétron é tirado do OM que cerca toda a molécula, enfraquecendo todas as quatro ligações igualmente. A TLV nos diria que um elétron é removido de um dos orbitais , resultando na necessidade por ressonância entre quatro ligações de valência, onde uma terá um elétron ligante enquanto as outras três teriam dois.
Como no benzeno, em substâncias como o beta caroteno, clorofila ou heme, alguns elétrons nos orbitais ficam espalhados em orbitais moleculares a longas distâncias em uma molécula, resultando em absorção de luz a baixas energias (espectro visível), o que contribui para as cores características destas substâncias. Esta e outras informações espectroscópicas para moléculas são melhor explicadas pela TOM, com ênfase nos estados eletrônicos associados com orbitais multicentralizados, incluindo mistura de orbitais fundamentais em princípios de simetria de orbitais combinados. Os mesmo princípios em orbitais moleculares também explicam mais naturalmente fenômenos elétricos, como alta condutividade elétrica na direção planar dos hexágonos do grafite. Na TOM, "ressonância" é uma consequência natural da simetria.
Por exemplo, no grafite, assim como no benzeno, não é necessário nos valer da hibridização e ressonância da TLV, para explicar condução elétrica. Em vez disso, a TOM encara alguns elétrons nas lâminas de grafite como deslocalizados, arbitrariamente distantes, e que eles residem em orbitais moleculares grandes que cobrem toda uma lâmina de grafite, alguns deles suficientemente livres para conduzir eletricidade no plano, como em um metal.
Aproximação Quantitativa
Para obter valores quantitativos dos níveis de energia molecular, é necessário ter em mãos orbitais moleculares[3]
Ver também
Referências
- ↑ 1,0 1,1 1,2 1,3 1,4 Yves Jean, François Volatron, An Introduction to Molecular Orbitals, Oxford University Press, 1993 ISBN 0-195-06918-8 (em inglês)
- ↑ 2,0 2,1 2,2 2,3 Teoria dos Orbitais Moleculares
- ↑ 3,0 3,1 3,2 3,3 3,4 3,5 Teoria dos Orbitais Moleculares
- ↑ «Teoria da Ligação de Valência (TLV)» (PDF). Consultado em 10 de setembro de 2014. Arquivado do original (PDF) em 11 de setembro de 2014
- ↑ 5,0 5,1 5,2 Catherine E. Housecroft, Alan G, Sharpe, Inorganic Chemistry, Pearson Prentice Hall; 2nd Edition, 2005, p. 29-33 ISBN 0-130-39913-2 (em inglês)
- ↑ Salvatore Califano, Pathways to Modern Chemical Physics , Springer Science & Business Media, 2012 ISBN 3-642-28180-X (em inglês)
- ↑ Joseph Stewart Fruton, Methods and Styles in the Development of Chemistry, Volume 245, American Philosophical Society, 2002 ISBN 0-871-69245-7 (em inglês)
- ↑ Teoria das Orbitais Moleculares (TOM)
- ↑ «Orbital Molecular» (PDF). Consultado em 10 de setembro de 2014. Arquivado do original (PDF) em 11 de setembro de 2014
Bibliografia
- Raymond Chang, Química Geral , McGraw Hill Brasil, 1975 ISBN 8-563-30817-3



















 " class="attachment-atbs-s-4_3 size-atbs-s-4_3 wp-post-image" alt="O que estudar para o enem 2023">
" class="attachment-atbs-s-4_3 size-atbs-s-4_3 wp-post-image" alt="O que estudar para o enem 2023"> " class="attachment-atbs-s-4_3 size-atbs-s-4_3 wp-post-image" alt="Qual melhor curso para fazer em 2023">
" class="attachment-atbs-s-4_3 size-atbs-s-4_3 wp-post-image" alt="Qual melhor curso para fazer em 2023"> " class="attachment-atbs-s-4_3 size-atbs-s-4_3 wp-post-image" alt="Enem: Conteúdos E Aulas On-Line São Opção Para Os Estudantes">
" class="attachment-atbs-s-4_3 size-atbs-s-4_3 wp-post-image" alt="Enem: Conteúdos E Aulas On-Line São Opção Para Os Estudantes"> " class="attachment-atbs-s-4_3 size-atbs-s-4_3 wp-post-image" alt="Como Fazer Uma Carta De Apresentação">
" class="attachment-atbs-s-4_3 size-atbs-s-4_3 wp-post-image" alt="Como Fazer Uma Carta De Apresentação"> " class="attachment-atbs-s-4_3 size-atbs-s-4_3 wp-post-image" alt="Como Escrever Uma Boa Redação">
" class="attachment-atbs-s-4_3 size-atbs-s-4_3 wp-post-image" alt="Como Escrever Uma Boa Redação"> " class="attachment-atbs-s-4_3 size-atbs-s-4_3 wp-post-image" alt="Concurso INSS edital 2022 publicado">
" class="attachment-atbs-s-4_3 size-atbs-s-4_3 wp-post-image" alt="Concurso INSS edital 2022 publicado">


