imported>NH~ptwiki |
imported>Cadnero mSem resumo de edição |
||
| Linha 1: | Linha 1: | ||
A | {{ver desambiguação}} | ||
{{Mais notas|data=agosto de 2020}} | |||
[[Ficheiro:A-DNA orbit animated small.gif|thumb|upright=1.5|A estrutura química do DNA]] | |||
A | '''Química'''<ref>Enciclopédia Mirador do Brasil, v.17, 1981 ISBN 85-7026-018-0</ref>{{Nota de rodapé|A palavra "química" surgiu na língua portuguesa no século XVIII, derivada do latim ''chimica''. A origem do termo é incerta, sendo ainda alvo de intensos debates. Costuma-se associá-la a palavra [[língua grega|grega]] ''khymeía'', que significa "mistura de substâncias líquidas"; ou ao grego ''khêmía'', que significa "[[magia negra]]"; ou ao [[língua egípcia|egípcio]] ''kêm'', que significa "negro".}} é a [[ciência]] que estuda a [[composição química|composição]], [[estrutura química|estrutura]], [[propriedades da matéria]], as mudanças sofridas por ela durante as [[reações químicas]] e a sua relação com a [[energia]].<ref name=definition>{{citar web | url=http://www.britannica.com/EBchecked/topic/108987/chemistry | título=Chemistry | publicado=[[Encyclopædia Britannica]] | língua=en|acessodata=14 de janeiro de 2013}}</ref><ref>{{citar web | url=http://dictionary.reference.com/browse/Chemistry | título=Chemistry | publicado=Dictionary.com | língua=en|acessodata=14 de janeiro de 2013}}</ref> É considerada uma [[ciência exata]] e é chamada muitas vezes de [[ciência central]] porque é a ponte entre outras [[ciências naturais]]{{harvRef|Brown|1999|p=3-4}}{{nota de rodapé|''Chemistry is seen as occupying an intermediate position in a hierarchy of the sciences by "reductive level" between physics and biology''.{{harvRef|Reinhardt|2001|p=1-2}}}} como [[Física]], [[Matemática]] e [[Biologia]]. A Química possui papel fundamental no [[Desenvolvimento tecnológico diferenciado|desenvolvimento tecnológico]], pois a utilização dos conceitos e técnicas dessa ciência permite a obtenção de novas [[substâncias]], além de preocupar-se com a prevenção de danos e exploração sustentável do [[meio ambiente]]. | ||
: | |||
As áreas da Química são agrupadas em quatro grandes divisões, a saber: [[Química Inorgânica]] (estuda a matéria inorgânica), [[Química Orgânica]] (estuda os compostos de carbono), [[Físico-Química]] (compreende os aspectos energéticos e cinéticos dos sistemas químicos e suas transformações em escalas macroscópicas, e atômico-molecular), e [[Química Analítica]] (analisa materiais e ajuda a compreender a sua composição e quantidade de sistemas químicos). Áreas interdisciplinares e complementares incluem [[Bioquímica]], Ensino de Química, e [[Química ambiental|Química Ambiental]]. | |||
No Brasil são considerados profissionais relacionados a ciências químicas, com registro nos Conselhos Federais e Regionais de Química: [[Engenharia química|Engenheiros Químicos]], [[Químico|Bacharéis e Licenciados em Química]], [[Química industrial|Bacharéis em Química Industrial ou Química Tecnológica]], [[Bioquímico|Bacharéis em Bioquímica]]. | |||
: | |||
== | == História == | ||
{{artigo principal|História da química|Cronologia de química}}O desenvolvimento desta ciência teve como base as observações de [[experiência científica|experimentos]], sendo portanto, considerada uma ciência experimental[[Imagem:Ca' Rezzonico - Gli alchimisti 1757 - Pietro Longhi.jpg|thumb|180px|esquerda|''O Alquimista'', de Pietro Longhi.]] | |||
Os [[filosofia|filósofos]] [[Grécia|grego]]s [[Empédocles]] e [[Aristóteles]] acreditavam que as [[substância]]s eram formadas por [[quatro elementos]]: [[terra]], [[vento]], [[água]] e [[fogo]]. Paralelamente, discorria outra teoria, o [[atomismo]], que postulava que a matéria era formada por [[átomo]]s, partículas indivisíveis que se podiam considerar a unidade mínima da matéria. Esta teoria, proposta pelo filósofo grego [[Demócrito de Abdera]], não foi popular na cultura ocidental, dado o peso das obras de Aristóteles na Europa. No entanto, tinha seguidores (entre eles [[Lucrécio]]) e a ideia ficou presente até o princípio da [[Idade Moderna]]. | |||
Entre os séculos III a.C. e o [[século XVI]] d.C., a Química estava dominada pela [[alquimia]]. O objetivo de investigação mais conhecido da alquimia era a procura da [[pedra filosofal]], um método hipotético capaz de transformar os metais em [[ouro]], e o [[elixir da longa vida]]. Na investigação alquímica desenvolveram-se novos produtos químicos e métodos para a separação de elementos químicos. Deste modo foram-se assentando os pilares básicos para o desenvolvimento de uma futura química experimental. O cientista irlandês [[Robert Boyle]] é tido por muitos como o iniciador da Química moderna, já que, em meados do século XVII, ele executou experimentos planejados, estabelecendo através deles [[teoria|generalizações]]. Apesar dos méritos de Boyle, muitos consideram o francês [[Antoine Lavoisier|Antoine Laurent Lavoisier]], que viveu no século XVIII, o pai da Química, especialmente devido ao seu trabalho sobre o conceito de [[conservação da massa]], sendo este considerado o marco do estabelecimento da química moderna, ocasionando a chamada [[Revolução Química]]. Os estudos de Lavoisier foram referência para que fosse proposto por [[John Dalton]], no início do [[século XIX]], o primeiro [[Modelo atômico#John Dalton|modelo atômico]]. A Química experimentou grande desenvolvimento teórico e metodológico durante o século XX, especialmente pelo estabelecimento da [[Química quântica|mecânica quântica]], [[espectroscopia|métodos espectroscópicos]] e [[síntese orgânica|metodologias de síntese orgânica]], que impulsionaram o descobrimento de novos fármacos, determinação da [[estrutura química]] de moléculas, como o [[ácido desoxirribonucleico]] e sofisticação das teorias já existentes | |||
== | ===A separação da Alquimia=== | ||
A Química, como é conhecida atualmente, começou a desenvolver-se entre os séculos [[século XVI|XVI]] e [[século XVII|XVII]]. Nessa época estudou-se o comportamento e propriedades dos [[gás|gas]]es estabelecendo-se técnicas de [[medição]]. Aos poucos, foi-se desenvolvendo e refinando o conceito de [[elemento químico|elemento]] como uma substância elementar que não podia ser descomposto em outras. Também esta época desenvolveu-se a [[teoria do flogisto]] para explicar os processos de [[combustão]]. | |||
[[Robert Boyle]] desenvolveu sua ''[[magnum opus]] "[[The Sceptical Chymist|O Químico Cético]]"'', abandonando as teorias aristotélicas de alquimia e contemplando a pesquisa experimental e conclusões com base em experimentos. [[Georg Ernst Stahl]] e [[Johann Joachim Becher]] desenvolveram em 1700 a [[teoria do flogisto]]. Esta teoria, que se manteve por 80 anos até ser refutada, afirmava que as substâncias suscetíveis de sofrer combustão continham o flogisto, e que o processo de combustão consistia basicamente na perda desta substância. A causa da má interpretação da teoria do flogisto era a então substância ainda desconhecida presente no ar, o [[oxigênio]]. [[Joseph Priestley]], estudando a composição do ar, percebeu a existência de uma substância no ar, a qual participava dos processos respiratórios e promovia reações de oxidação de metais aos seus óxidos. A teoria de elementos de Boyle considerava que um elemento químico era uma pluralidade de átomos idênticos, indivisíveis. | |||
Por volta do [[século XVIII]], a Química adquire definitivamente as características de uma ciência experimental. Desenvolvem-se métodos de medição cuidadosos que permitem um melhor conhecimento de alguns [[fenómeno]]s, como o da combustão da matéria; [[Antoine Lavoisier]] foi o responsável por perceber a presença do carbono nos seres vivos e a complexidade de suas ligações em relação aos compostos inorgânicos e refutador da teoria do flogisto, e assentou finalmente os pilares fundamentais da Química moderna. | |||
===Desenvolvimento da tabela periódica=== | |||
O período seguinte foi a busca de novos elementos químicos, a determinação de seus pesos atômicos exatos e sua caracterização por reações com outras substâncias, sendo essa uma das tarefas mais importantes da Química inorgânica. [[Lothar Meyer]] e [[Dmitri Mendeleev]] ordenaram os elementos químicos por massa atômica e com base na capacidade de fazer ligações químicas, originando a [[tabela periódica]]. [[Svante Arrhenius]], [[Jacobus Henricus van 't Hoff]] e [[Wilhelm Ostwald]] estimaram a [[constante de dissociação]] de sais, ácidos e bases em soluções aquosas. [[Alfred Werner]] questionou a validade das teorias e modelos aceitos na Química Orgânica, estruturando a nova química inorgânica em termos dos conceitos de coordenação e de [[estereoquímica]]. | |||
== | Antes do [[século XIX]], os químicos acreditavam que os compostos obtidos a partir de muitos organismos vivos eram demasiadamente complexos para serem sintetizados. De acordo com o conceito de [[vitalismo]], a matéria orgânica era dotada de uma "força vital". Esses compostos foram nomeados como "orgânicos", porém durante a primeira metade do século XIX os cientistas descobriram que os compostos orgânicos poderiam ser sintetizados em laboratório. Em 1828, [[Friedrich Wöhler]] produziu a [[ureia]], um componente da [[urina]], a partir do sal inorgânico [[cianato de amônio]] e, embora Wöhler sempre tenha sido cauteloso sobre a alegação de que teria refutado a teoria da força vital, esse evento tem sido muitas vezes visto como um marco para o estabelecimento da Química Orgânica. A descoberta do [[petróleo]] e a sua separação em frações de acordo com a diferença no ponto de ebulição de seus componentes foi outra etapa importante da história da ciência. Já a [[indústria farmacêutica]] teve seu início na última década do século XIX, com a fabricação de [[ácido acetilsalicílico]] (mais conhecido por como aspirina) pela [[Bayer]] na [[Alemanha]].<ref>{{citar web|url=http://www.telegraph.co.uk/health/healthnews/8184625/History-of-aspirin.html|último=Roberts|primeiro=L|publicado=Telegraph|título=The Telegraph History of Aspirin|língua=en|acessodata=27 de dezembro de 2012}}</ref> | ||
Com os trabalhos sobre [[termodinâmica química]], [[eletrólito]]s em [[solução|soluções]], [[cinética química]] e outros assuntos entre as décadas de 1860 a 1880, originou-se a Físico-Química moderna. O marco foi a publicação em 1876 por [[Josiah Willard Gibbs]] de seu artigo, sobre o equilíbrio de substâncias heterogêneas. Este artigo apresentou vários dos pilares da Físico-Química, como a [[energia livre de Gibbs]], os [[potencial químico|potenciais químicos]] e a [[regra das fases de Gibbs]].{{harvRef|Gibbs|1876}} Outros marcos incluem a introdução dos termos ''[[entalpia]]'' por [[Heike Kamerlingh Onnes]] e [[macromolécula|processos macromoleculares]]. | |||
O primeiro método de análise instrumental foi desenvolvido por [[Robert Bunsen]] e [[Gustav Kirchhoff]] e foi baseado na [[Espectroscopia de absorção atômica|espectroscopia de absorção atômica de chama]]. Utilizando essa técnica, eles descobriram, em 1860, elementos como o [[rubídio]] (Rb) e o [[césio]] (Cs).<ref>Analytical Sciencess, 2001, v.17 supplement [http://wwwsoc.nii.ac.jp/jsac/analsci/ICAS2001/pdfs/0500/0571_3i05n.pdf] {{Wayback|url=http://wwwsoc.nii.ac.jp/jsac/analsci/ICAS2001/pdfs/0500/0571_3i05n.pdf |date=20120823193947 }}, Basic Education in Analytical Chemistry</ref> Durante este período a análise instrumental tornou-se progressivamente dominante. Em particular, muitas das técnicas espectroscópicas e de espectrometria básicas foram descobertas no início do século XX e aperfeiçoadas até o final do século XX.<ref>[[Talanta]] Volume 51, Issue 5, p921-933 [http://dx.doi.org/10.1016/S0039-9140(99)00358-6], Review of analytical next term measurements facilitated by drop formation technology</ref> Os [[Separação de misturas|processos de separação]] se desenvolveram na linha de tempo de modo similar e também tornaram-se cada vez mais instrumentais.<ref>TrAC Trends in Analytical Chemistry Volume 21, Issues 9-10, Pages 547-557 [http://dx.doi.org/10.1016/S0165-9936(02)00806-3], History of gas chromatography</ref> | |||
===Bioquímica e Química Quântica=== | |||
A Bioquímica, anteriormente chamada de Química Biológica ou Fisiológica,<ref name="Enciclopédia Barsa">{{Citar enciclopédia| enciclopédia=Enciclopédia Barsa|título=Bioquímica|editor= Enciclopaedia Britannica do Brasil|volume=IV|páginas = 98, 102|ano=1989}}</ref> surgiu a partir das investigações de fisiologistas e químicos sobre compostos e conversões químicas em seres humanos e plantas no século XIX <ref name="Reaumur 1752">{{citar periódico|último = de Réaumur |primeiro = RAF |autorlink = René Antoine Ferchault de Réaumur |ano= 1752 |título= Observations sur la digestion des oiseaux |periódico= Histoire de l'academie royale des sciences | volume = 1752|páginas= 266, 461}}</ref><ref>[http://etext.lib.virginia.edu/toc/modeng/public/Wil4Sci.html Williams, H. S. (1904) A History of Science: in Five Volumes. Volume IV: Modern Development of the Chemical and Biological Sciences Harper and Brothers (New York)]</ref> O termo Bioquímica foi proposto pelo químico e médico alemão [[Carl Neuberg]] (1877-1956) em [[1903]], embora no século XIX grandes pesquisadores, como [[Wohler]], [[Liebig]], [[Pasteur]] e [[Claude Bernard]], estudassem a Química da vida sobre outras denominações.<ref name="Enciclopédia Barsa"/><ref>UFRJ. [http://www.bioqmed.ufrj.br/enzimas/cronologia.htm Cronologia dos eventos em enzimologia] {{Wayback|url=http://www.bioqmed.ufrj.br/enzimas/cronologia.htm |date=20130622133106 }}. Acesso: 4/5/2009</ref> | |||
Com a [[Segunda Guerra Mundial]], o mundo ingressou na era atômica, marcada pelo descobrimento dos elementos transurânicos e pelos avanços na [[radioquímica]]. A disponibilização de isótopos permitiu a realização de experimentos importantes sobre o comportamento cinético e mecanístico dos compostos inorgânicos, o qual foi racionalizado por [[Henry Taube]], em 1949, com base nas teorias de ligação. O entendimento lógico do caráter lábil/inerte dos compostos de coordenação lançou a semente dos mecanismos de transferência de elétrons, propostos por Taube em 1953, definitivamente consagrados com o Prêmio Nobel que lhe foi outorgado em 1983. | |||
Desde a metade do século XX, com o desenvolvimento de novas técnicas como a cromatografia, a difracção de raios X, marcação por isótopos e o [[microscópio eletrônico]], houve avanço na área da Bioquímica. Essas técnicas abriram o caminho para a análise detalhada e a descoberta de muitas moléculas e rotas metabólicas das células, como a [[glicólise]], [[ciclo de Krebs]] (ciclo dos [[ácidos tricarboxílicos]]) e a [[fosforilação oxidativa]] (cadeia transportadora de elétrons). | |||
== Princípios da Química moderna == | |||
Tradicionalmente, os princípios da Química se iniciam com o estudo das [[partícula elementar|partículas elementares]], átomos, moléculas,<ref>{{citar web | url=http://www.visionlearning.com/library/module_viewer.php?mid=49 | título=Matter: Atoms from Democritus to Dalton }} by Anthony Carpi, Ph.D.</ref> substâncias e outros agregados da matéria. '''Matéria''' é tudo aquilo que ocupa [[Espaço físico|espaço]] e possui [[massa]] de repouso (ou [[massa invariante]]). É um termo geral para a substância da qual todos os [[Corpo físico|objetos físicos]] consistem.<ref name=Penrose>{{citar livro |autor =R. Penrose |ano=1991 |capítulo=The mass of the classical vacuum |editores=S. Saunders, H.R. Brown |título=The Philosophy of Vacuum|url=http://books.google.com/?id=ZU1LL4IbDKcC&pg=PA21 |página=21 |publicado=[[Oxford University Press]] |isbn=0-19-824449-5}}</ref><ref name=mcgrawhill> | |||
{{citar web | |||
|título=Matter (physics) | |||
|url=http://www.accessscience.com/abstract.aspx?id=410600&referURL=http%3a%2f%2fwww.accessscience.com%2fcontent.aspx%3fid%3d410600 | |||
|obra=McGraw-Hill's Access Science: Encyclopedia of Science and Technology Online | |||
|acessodata=24 de maio de 2009 | |||
|arquivourl=https://web.archive.org/web/20110617073828/http://www.accessscience.com/abstract.aspx?id=410600&referURL=http%3A%2F%2Fwww.accessscience.com%2Fcontent.aspx%3Fid%3D410600 | |||
|arquivodata=2011-06-17 | |||
|urlmorta=yes | |||
}} | |||
</ref> Tipicamente, a matéria inclui [[átomo]]s e outras [[Lista de partículas|partículas]] que possuem massa. A massa é dita por alguns como sendo a quantidade de matéria em um objeto e [[volume]] é a quantidade de espaço ocupado por um objeto, mas esta definição confunde massa com matéria, que não são a mesma coisa.<ref name=Mongillo> | |||
{{citar livro |autor =J. Mongillo |ano=2007 |título=Nanotechnology 101 |url=http://books.google.com/?id=j69lwrrQ4nsC&pg=PA30 |página=30 |publicado=[[Greenwood Publishing]] |isbn=0-313-33880-9}}</ref> Diferentes campos usam o termo de maneiras diferentes e algumas vezes incompatíveis; não há um único significado científico que seja consenso para a palavra "matéria", apesar do termo "massa" ser bem definido. A matéria pode ser encontrada principalmente nos estados sólido, líquido e gasoso, em forma isolada ou em combinação. Reações químicas<ref>IUPAC [[Gold Book]] [http://www.iupac.org/goldbook/C01033.pdf Definition] {{Wayback|url=http://www.iupac.org/goldbook/C01033.pdf |date=20090930144312 }}</ref> e outras transformações como as mudanças de fase envolvem o rearranjo de ligações químicas e outras interações entre as moléculas. Estas transformações envolvem invariavelmente diversos conceitos importantes como [[energia]], [[equilíbrio químico]] entre outros. A seguir serão explanados as principais entidades usadas para descrever a matéria bem como alguns conceitos que permeiam as transformações sofridas pela matéria. | |||
=== Espécies químicas === | |||
'''''[[Quark]]''''' | |||
O '''[[quark]]''', na [[física de partículas]], é uma [[partícula elementar]] e um dos dois constituintes fundamentais da matéria (o outro é o [[lépton]]). Quarks se combinam para formar partículas compostas chamadas [[Hádron|hádrons]] das quais as mais estáveis desse tipo são os [[Próton|prótons]] e os [[Nêutron|nêutrons]], que são os principais componentes dos [[Núcleo atómico|núcleos atômicos]]. Devido a um fenômeno conhecido como [[Confinamento (física)|confinamento de cor]], os quarks nunca são diretamente observados ou encontrados de forma isolada; eles podem ser encontrados apenas nos hádrons, como os [[Bárion|bárions]] (categoria a que pertencem os prótons e os nêutrons), e os [[Méson|mésons]]. Por essa razão, muito do que se sabe sobre os quarks advém da observação dos hádrons. | |||
'''''[[Átomo]]''''' | |||
{{artigo principal|Átomo}} | |||
[[Imagem:Stylised atom with three Bohr model orbits and stylised nucleus.png|thumb|130px|direita|Representação clássica de um átomo segundo [[Modelo atômico de Rutherford|modelo]] proposto por [[Ernest Rutherford|Rutherford]] e [[Niels Bohr|Bohr]].]] | |||
O átomo é a unidade básica de matéria que consiste de um núcleo denso central rodeado por uma nuvem de [[elétron]]s de carga negativa. O núcleo atômico contem [[próton]]s carregados positivamente e [[nêutron]]s eletricamente neutros (exceto o [[hidrogênio]]-1, que é o [[nuclídeo]] estável sem nêutrons). Os elétrons de um átomo interagem com o núcleo por [[força eletromagnética]], e do mesmo modo, um grupo de átomos permanecem ligados uns aos outros por ligações químicas baseadas nesta mesma força, formando uma molécula. Um átomo que contém o mesmo número de prótons e elétrons é eletricamente neutro, caso contrário é carregado positivamente ou negativamente e é chamado de [[íon]]. Um átomo é classificado de acordo com o número de prótons e nêutrons no seu núcleo: o número de prótons determina o [[elemento químico]] e o número de nêutrons determina o [[isótopo]] do elemento.{{nota de rodapé|''Um átomo é a menor unidade que representa um elemento químico, sozinho ou em combinação com outros átomos do mesmo ou de outros elementos''{{harvRef|name="leigh1990"|Leigh|1990|p=35}}}} O modelo atualmente aceito para explicar a estrutura atômica é o [[mecânica quântica|modelo da mecânica quântica]].<ref>{{citar web|título=chemical bonding|url=http://www.britannica.com/EBchecked/topic/684121/chemical-bonding/43383/The-quantum-mechanical-model|obra=Britannica|publicado=Encyclopædia Britannica|acessodata=1 de novembro de 2012}}</ref> | |||
'''''[[Antiátomo]]''''' | |||
{{artigo principal|Antiátomo}} | |||
Antiátomos constituem a [[antimatéria]], possuindo [[carga elétrica|cargas elétricas]] inversas às dos átomos. São compostos por [[antipartícula]]s denominadas [[pósitron]]s, [[antipróton]]s e [[antinêutron]]s. | |||
'''''[[Elemento (química)|Elemento]]''''' | |||
{{artigo principal|Elemento químico}} | |||
Elemento químico é o termo coletivo para todos os tipos de átomos com o mesmo [[número atômico]]. Assim, todos os átomos de um elemento químico possuem necessariamente o mesmo número de prótons no núcleo. Um elemento é identificado por um símbolo, uma abreviatura que é na maioria dos casos derivada do nome em [[latim]] do elemento [por exemplo, [[chumbo|Pb]] (''plumbum''), [[ferro|Fe]] (''ferrum''). Os elementos estão dispostos na [[tabela periódica]] em ordem crescente do número atômico. Um total de 118 elementos são conhecidos até esta data (2018). | |||
'''''[[Composto químico|Composto]]''''' | |||
{{artigo principal|Composto químico}} | |||
== | Um composto químico é uma substância química pura composta por dois ou mais elementos químicos diferentes.{{harvRef|name="Brown p.6"|Brown|2009|p=5-6}}{{harvRef|name=”Hill p.6”|Hill|2005|p=6}}{{harvRef|name="Whitten p.15"|Whitten|2000|p=15}} Os compostos químicos têm uma estrutura química única e definida e consistem em uma razão fixa de átomos, que são mantidos juntos num arranjo espacial definido por ligações químicas. Os átomos de um composto químico podem ser unidos por [[ligação covalente|ligações covalentes]], [[ligação iônica|ligações iônicas]], [[ligação metálica|ligações metálicas]] ou por [[Ligação covalente dativa|ligações covalentes coordenadas]]. Os elementos químicos não são considerados compostos químicos, mesmo que consistam em moléculas que contenham múltiplos átomos de um único elemento (como H<sub>2</sub>, S<sub>8</sub>, etc.), sendo estas chamadas moléculas diatômicas ou moléculas poliatômicas.{{harvRef|Halal|2008|p=96-98}} A nomenclatura de compostos químicos é uma parte crucial da linguagem química. No início da história, estes eram batizados com o nome de seu descobridor. No entanto hoje, a nomenclatura padrão é definida pela União Internacional de Química Pura e Aplicada ([[IUPAC]]). O sistema IUPAC de nomenclatura permite a distinção dos compostos por nomes específicos. | ||
[[ | '''''[[Substância]]''''' | ||
{{artigo principal|Substância química}} | |||
{{AP|vt=s|Identificador Químico Internacional}} | |||
= | Uma substância química é um tipo de matéria com composição e conjunto de propriedades definidos.{{harvRef|Hill|2005|p=37}} Estritamente falando, uma mistura de compostos, elementos e compostos ou elementos não é uma substância química, mas pode ser chamado de [[produto químico]]. A maioria das substâncias que encontramos em nossa vida diária são misturas, como por exemplo o [[ar]] e a [[biomassa]]. | ||
[[ | '''''[[Molécula]]''''' | ||
{{artigo principal|Molécula}} | |||
[[ | [[Imagem:Taxol.svg|thumb|180px|esquerda|A estrutura de uma molécula apresenta ligações covalentes e é eletricamente neutra, como observado na estrutura do [[Paclitaxel]].]] | ||
[[ | Uma molécula é uma entidade eletricamente neutra formada de dois ou mais átomos unidos por ligações covalentes.<ref name="iupac">{{GoldBookRef|título=molecule|url=http://goldbook.iupac.org/M04002.html|ano=1994}}</ref>{{harvRef|Pauling|1970}}{{harvRef|Ebbin|1990}}{{harvRef|Brown|2003}}{{harvRef|Chang|1998}}{{harvRef|Zumdahl|1997}} As moléculas são distinguidas dos íons pela ausência de [[carga elétrica]]. No entanto, em Física Quântica, Química Orgânica e Bioquímica, o termo ''molécula'' é usado frequentemente com menor rigor, sendo aplicado também aos íons poliatômicos. Na teoria cinética dos gases, o termo molécula é frequentemente utilizado para qualquer partícula gasosa, independentemente da sua composição. De acordo com essa definição, átomos de [[gás nobre|gases nobres]] são considerados moléculas, apesar do fato de que elas são compostas por um único átomo sem ligação química.{{harvRef|Chandra|2005}} Uma molécula pode ser constituída por átomos de um único elemento químico, tal como com o oxigênio gasoso (O<sub>2</sub>), ou de diferentes elementos, como acontece com a água (H<sub>2</sub>O). Átomos e complexos ligados por ligações covalentes, como pontes de hidrogênio ou ligações iônicas geralmente não são considerados moléculas individuais.<ref>{{citar web|url=http://www.britannica.com/EBchecked/topic/388236/molecule|título=Molecule|publicado=Encyclopædia Britannica on-line|língua=en|acessodata=14 de janeiro de 2013}}</ref> | ||
{{clr}} | |||
'''''[[Íon]]''''' | |||
{{artigo principal|Íon}} | |||
[[ | O {{PBPE|íon|ião}} é uma partícula eletricamente carregada, ou seja, é um átomo ou uma molécula que perdeu ou ganhou elétrons. Um íon é chamado [[cátion]] quando perde um ou mais elétrons, que são negativos, ficando carregado positivamente (por exemplo, o cátion sódio: Na<sup>+</sup>). Por outro lado, os [[ânion]]s são os íons carregados negativamente, ou seja, ganharam eletróns (por exemplo, ânion cloreto: Cl<sup>−</sup>). Como exemplos de íons poliatômicas podem ser citados os íon [[hidróxido]] (OH<sup>−</sup>) ou o íon [[fosfato]] (PO<sub>4</sub><sup>3−</sup>). Os íons no [[Estados físicos da matéria|estado]] [[Gás|gasoso]] são frequentemente chamados de [[plasma]]. | ||
=== Conceitos envolvidos na transformação da matéria === | |||
'''''Acidez e basicidade''''' | |||
{{artigo principal|Reação ácido-base}} | |||
[[ | Substâncias possuem propriedades ácidas e/ou básicas. Existem diferentes teorias que explicam o comportamento ácido-base. A mais simples é a teoria de Arrhenius, que diz que um ácido é uma substância que produz íons [[hidrônio]], quando dissolvida em água; e uma base é uma substância que produz íons [[hidroxila]], quando dissolvida em água. De acordo com a [[teoria ácido-base de Brønsted-Lowry]], ácidos são substâncias que doam um cátion hidrogênio a outra substância em uma reação química; por extensão, uma base é a substância que recebe estes íons hidrogênio. A terceira teoria é teoria ácido-base de Lewis, o qual é baseado na formação de ligações químicas. A teoria de Lewis explica que um ácido é uma substância que é capaz de aceitar um [[par de elétrons]] de uma outra substância durante o processo de formação da ligação química, enquanto que a base é uma substância que cede um par de elétrons para formar uma nova ligação.<ref>{{citar web|url=http://www.apsidium.com/theory/lewis_acid.htm|título=The Lewis Acid-Base Concept|obra=Apsidium|língua=en|acessodata=14 de janeiro de 2013|arquivourl=https://web.archive.org/web/20080527132328/http://www.apsidium.com/theory/lewis_acid.htm|arquivodata=27 de maio de 2008|urlmorta=yes}}</ref> Existem várias outras maneiras em que uma substância pode ser classificada como um ácido ou de uma base, como é evidente na história deste conceito.<ref>{{citar web|url=http://www.bbc.co.uk/dna/h2g2/A708257|título=History of Acidity |publicado=Bbc.co.uk|língua=en|acessodata=14 de janeiro de 2013}}</ref> | ||
[[ | A acidez pode ser mensurada especialmente por dois métodos. Uma delas, com base na definição de Arrhenius de acidez, é o [[potencial hidrogeniônico]] (pH). O pH é definido como o [[logarítmo]] decimal do inverso da [[atividade (química)|atividade]] de íons hidrogênio, ''a''<sub>H</sub>+, em uma solução.<ref name=covington>{{citar periódico|doi=10.1351/pac198557030531|último1 =Covington|url=http://www.iupac.org/publications/pac/1985/pdf/5703x0531.pdf|primeiro1 =A. K.|último2 =Bates|primeiro2 =R. G.|último3 =Durst|primeiro3 =R. A. |título=Definitions of pH scales, standard reference values, measurement of pH, and related terminology|periódico=Pure Appl. Chem. |ano=1985|volume=57|páginas=531–542|número=3}}</ref> Assim, as soluções que têm um baixo pH tem alta concentração de íons hidrônio, e pode-se dizer que são mais ácidas. | ||
[[ | Outra maneira, que tem como base a definição de Bronsted-Lowry, é a [[constante de acidez|constante de dissociação de um ácido]] (K<sub>a</sub>), que medem a capacidade relativa de uma substância para agir como um ácido sob a definição de Bronsted-Lowry. Isto é, as substâncias com um K<sub>a</sub> maior são mais propensas a doar íons hidrogênio em reações químicas do que aquelas com menores valores de K<sub>a</sub>. | ||
[[ | '''''Fase''''' | ||
{{artigo principal|[[Fase (química)|Fase]]}} | |||
[[Imagem:Phase-diag.svg|thumb|250px|direita|Um típico [[diagrama de fase]], detalhando a variação de fases da água em termos de pressão e temperatura. A linha pontilhada dá o comportamento anômalo da água. As linhas verdes marcam o [[ponto de congelamento]] e a linha azul o [[ponto de ebulição]].]] | |||
[[ | Em ciências físicas, ''fase'' é uma região do espaço (um [[sistema termodinâmico]]), no qual todas as propriedades físicas são essencialmente uniformes.{{harvRef|Modell|1974}} Exemplos de propriedades físicas incluem a [[densidade]], [[índice de refração]], [[magnetização]] e composição química. Uma descrição mais simples é que uma fase é uma região de um material que é quimicamente uniforme, fisicamente distinta e (frequentemente) mecanicamente separáveis. Num sistema composto por gelo e água num frasco de vidro, os cubos de gelo são uma fase, a água é uma segunda fase e o ar úmido sobre a água é uma terceira fase. | ||
[[ | A termo ''fase'' é usado às vezes como sinônimo de [[estado da matéria]]. Além disso, por vezes é utilizado para se referir a um conjunto de estados de equilíbrio demarcados em termos de variáveis de estado, tais como pressão e temperatura por um limite de fase em um [[diagrama de fase]]s. Como os limites de fase se relacionam às alterações na organização da matéria, tais como a mudança do estado líquido para o estado sólido ou de uma alteração mais sutil de uma estrutura de cristal para o outro, este último uso é semelhante à utilização de ''fase'' como sinônimo de estado da matéria. No entanto, o uso dos termos ''estado da matéria'' e ''diagrama de fase'' não são compatíveis com a definição formal citada acima e o significado pretendido deve ser determinado a partir do contexto em que o termo é utilizado. Diferentes tipos de estados ou fases são considerados com o [[sólido]], [[líquido]] e [[gasoso]], o [[condensado de Bose-Einstein]] e o [[plasma]], sendo que estes dois últimos são estudados em níveis avançados da [[física]]. | ||
[[ | '''''Ligação''''' | ||
{{artigo principal|Ligação química}} | |||
Uma ligação química ocorre quando uma interação entre os átomos permite a formação de substâncias químicas que contêm dois ou mais átomos. A ligação é provocada por [[Lei de Coulomb|força de atração eletrostática]] entre as cargas opostas, quer entre elétrons e os núcleos, ou como o resultado de uma [[dipolo|atração dipolar]]. A força das ligações químicas varia consideravelmente em termos energéticos; existem "ligações fortes", como as ligações covalentes ou iônicas e "ligações fracas", tais como [[força dipolo permanente|interações dipolo-dipolo]], a [[Forças de Van der Waals|força dispersão de London]] e [[ligação de hidrogênio|ligações de hidrogênio]]. A muitos compostos, a [[ligação de valência|teoria da ligação de valência]], o modelo de repulsão dos pares eletrônicos ([[Teoria da repulsão dos pares de elétrons da camada de valência|VSEPR]]) e o conceito do [[número de oxidação]] são usados para explicar a estrutura molecular e formação das ligações químicas. Outras teorias de ligação, como a [[orbital molecular|teoria do orbital molecular]] também são muito utilizadas. | |||
'''''Reação''''' | |||
{{artigo principal|Reação química}} | |||
[[Imagem:Iodine clock - persulphate.ogv|thumb|180px|esquerda|Vídeo demonstrando uma reação química. Duas soluções incolores são misturadas (uma solução contendo íons persulfato ou outra contendo íons iodeto). Aparentemente nada acontece. Passados alguns segundos, a solução se torna azulada. [[Iodo]] molecular e íons [[sulfato]] são os produtos desta reação.]] | |||
Uma reação química é um processo que leva a transformação de uma substâncias a outra.<ref>{{citar web|url = http://goldbook.iupac.org/C01033.html|ano=2006|título=IUPAC Compendium of Chemical Terminology |publicado=[[IUPAC]]|último=Nic|primeiro=M|coautores=Jirat, J.; Kosata, B. |língua=en|doi=10.1351/goldbook.C01033|acessodata=13 de janeiro de 2013}}</ref> Classicamente, as reações químicas compreendem alterações que envolvem o movimento dos elétrons na formação e quebra de ligações químicas entre os átomos. A substância (ou substâncias) inicialmente envolvida numa reação química é chamada de [[reagente]]. As reações químicas produzem um ou mais [[produto (química)|produto]]s, que em geral têm propriedades diferentes das dos reagentes. Reações muitas vezes consistem de uma sequência de subetapas e as descrição exata sobre o curso destas reações ilustram um [[mecanismo de reação]]. As reações químicas são descritas com [[equação química|equações químicas]] que apresentam graficamente os materiais de partida, os produtos finais e os intermediários, por vezes, as condições de reação. | |||
Reações químicas acontecem a uma [[taxa de reação|taxa reacional]] característica a uma dada concentração e temperatura. Reações que ocorrem rapidamente são descritas como espontâneas, que não exigem o fornecimento de energia extra. As reações não espontâneas ocorrem tão lentamente que exigem a introdução de algum tipo de energia adicional (tal como o calor, luz ou de eletricidade), a fim de se completar ou atingir o [[equilíbrio químico]]. | |||
Diferentes reações químicas são combinadas durante a [[síntese química]], de modo a obter um produto desejado. Em bioquímica, uma série de reações químicas formam as [[via metabólica|vias metabólicas]]. Essas reações são geralmente mediadas por [[enzima]]s. Essas enzimas catalisam muitas reações que não ocorreriam sob condições presentes no interior de uma célula. | |||
O conceito geral de reação química foi estendido para entidades menores do que os átomos, incluindo as [[reação nuclear|reações nucleares]], [[decaimento radioativo|decaimentos radioativos]] e reações entre partículas elementares, como descrito pela [[teoria quântica de campos]]. | |||
{{clr}} | |||
'''''Mol''''' | |||
{{artigo principal|Mol}} | |||
O mol é o nome da [[Unidades básicas do SI|unidade de base do Sistema Internacional de Unidades]] ([[Sistema Internacional de Unidades|SI]]) para a grandeza ''[[quantidade de matéria]]''.<ref name ="SILVA">{{citar periódico|autor=SILVA, R. R.; ROCHA-FILHO, R. C.|titulo=Mol: uma nova terminologia|jornal=Quím. Nova Esc.|local=São Paulo|numero=1|páginas=12-14|mes=maio|ano=1995|url=http://qnesc.sbq.org.br/online/qnesc01/atual.pdf}}</ref><ref name="INMETRO">{{citar web|titulo=INMETRO Unidades legais de medida|url=http://www.inmetro.gov.br/consumidor/unidLegaisMed.asp|acessodata=27/08/2010}}</ref> É uma das sete unidades de base do [[Sistema Internacional de Unidades]].{{harvRef|name="MILLS"|Mills|1993|p=4}} O seu uso é comum para simplificar representações de proporções químicas e no cálculo de [[molaridade|concentração]] de [[substância]]s. O [[Escritório Internacional de Pesos e Medidas]] define: "Um mol contém exatamente 6,022 140 76 x 10<sup>23</sup> entidades elementares".<ref>{{Citar web|url=https://physics.nist.gov/cuu/Units/current.html|titulo=Current definitions of the SI base units|acessodata=2022-01-03|website=National Institute of Standards and Technology|ano=2019}}</ref> | |||
'''''Redox''''' | |||
{{artigo principal|Reação de oxirredução}} | |||
Reações redox (redução-oxidação) incluem todas as reações químicas em que átomos têm o seu [[estado de oxidação]] alterado por transferência de elétrons, seja pelo ganho ([[redução]]) ou perda de elétrons ([[oxidação]]). As substâncias que possuem a capacidade de oxidar outras substâncias são chamadas de oxidantes (agentes oxidantes). Do mesmo modo, as substâncias que tem a capacidade de reduzir outras substâncias são ditas redutoras e são conhecidos como agentes redutores. Um redutor transfere elétrons a outra substância, então ele sofre oxidação. A oxidação e redução refletem a alteração no [[número de oxidação]] - a transferência efectiva de electrões nunca pode ocorrer. Assim, a oxidação é melhor definida como um aumento no número de oxidação, de redução e como uma diminuição no número de oxidação. | |||
'''''Equilíbrio''''' | |||
{{artigo principal|Equilíbrio químico}} | |||
Em uma reação química, o ''equilíbrio químico'' é o estado em que ambos os reagentes e produtos estão presentes em concentrações e estas não tendem a se alterar com o tempo.{{harvRef|Atkins|2006|p=200-202}} Geralmente, este estado resulta quando a reação (produtos para reagentes) prossegue à mesma taxa que a reação inversa (produtos para reagentes). As taxas reacionais de ambas não são iguais a zero, mas sendo iguais, não existem alterações líquidas das concentrações tanto dos reagentes quanto dos produtos. Esse processo é chamado de [[equilíbrio dinâmico (química)|equilíbrio dinâmico]].{{harvRef|name=aj|Atkins|2008}}<ref>{{GoldBookRef|título=chemical equilibrium|arquivo=C01023}}</ref> | |||
'''''Energia''''' | |||
{{artigo principal|Energia}} | |||
No contexto de Química, a energia é um atributo de uma substância como uma consequência da agregação de sua estrutura atômica ou molecular. Uma vez que uma transformação química gera mudanças na estrutura de uma substância, o processo é invariavelmente acompanhado por um aumento ou diminuição de energia nas substâncias envolvidas. Parte da energia é transferida entre o ambiente e os reagentes sob a forma de calor ou de luz; assim, os produtos de uma reação podem ser mais ou menos energéticos do que os reagentes. | |||
A reação é dita ser [[exergónica|exergônica]] a variação da [[energia livre de Gibbs]] tem valor negativo, indicando a possibilidade de uma reação espontânea. No caso de [[reação endergônica|endergônica]]s a situação é inversa. A reação é dito ser [[Reação exotérmica|exotérmica]] se liberta calor para o ambiente e as [[Reação endotérmica|reações exotérmica]]s absorvem o calor do meio. | |||
As reações químicas são invariavelmente impossível, a menos que os reagentes superem uma barreira de energia conhecida como [[energia de ativação]]. A velocidade de uma reação química (em dada temperatura ''T'') está relacionada com a energia de ativação ''E'' pelo [[Factor de Boltzmann|Fator de Boltzmann]], <math>e^{-E/kT} </math> - que expressa a possibilidade de uma molécula ter uma energia maior ou igual a ''E'' em dada temperatura ''T''. Esta dependência exponencial da taxa de reação em dada temperatura é conhecida como [[equação de Arrhenius]]. A energia de ativação necessária para que uma reação química ocorra pode ser na forma de calor, luz, eletricidade ou força mecânica sob a forma de [[ultra-som]].<ref>Reilly, Michael. (2007). [http://www.newscientisttech.com/article/dn11427 Mechanical force induces chemical reaction], NewScientist.com news service, Reilly {{Wayback|url=http://www.newscientisttech.com/article/dn11427 |date=20070325203212 }}</ref> | |||
O conceito de energia livre, que também incorpora considerações sobre [[entropia]], é um meio muito útil para prever a possibilidade de ocorrência de uma reação química e determinar o estado de equilíbrio de uma reação em [[termodinâmica química]]. A reacção só é possível se a mudança total na energia livre de Gibbs negativa, <math> \Delta G \le 0 \,</math>, e, se for igual a zero, a reação química está em equilíbrio. | |||
Existem apenas limitados possíveis estados de energia para elétrons, átomos e moléculas. Estas são determinadas pelas regras da [[mecânica quântica]], que exigem [[quantização (física)|quantização da energia]]. Os átomos e moléculas em um estado energético estão em [[estado excitado]]. Moléculas e átomos que substância neste estado energético são frequentemente muito mais reativos, isto é, mais passíveis de reações químicas. | |||
A fase de uma substância é determinada pela sua energia própria e a energia do ambiente. Quando as [[força intermolecular|forças intermoleculares]] de uma substância é tal que a energia do ambiente não é suficiente para superá-las, ocorrem então as fases mais ordenada, como líquido e sólido, como é o caso com a água (H<sub>2</sub>O), um líquido à temperatura ambiente porque as suas moléculas interagem por ligações de hidrogênio.<ref>{{citar web | url=http://www.chem4kids.com/files/matter_changes.html | título=Changing States of Matter }} - Chemforkids.com</ref> O [[sulfeto de hidrogênio]] (H<sub>2</sub>S) é um gás a temperatura e pressão padrão porque as suas moléculas interagem por interações dipolo-dipolo, que são mais fracas. | |||
A transferência de energia a partir de uma substância química para outra depende do tamanho dos [[quantum|quanta]] de energia emitidos a partir de uma substância. No entanto, a energia térmica é frequentemente transferida mais facilmente de qualquer substância para outra porque os [[fônon]]s responsáveis pelos níveis de energia vibracional e rotacional em uma substância têm muito menos energia do que os [[fóton]]s invocados para a transferência de energia eletrônica. Assim, devido aos níveis de energia vibracional e rotacional serem mais próximos espacialmente mais espaçados do que os níveis eletrônicos de energia, o calor é mais facilmente transferido entre substâncias em relação à luz ou de outras formas de energia eletrônica. Por exemplo, a radiação eletromagnética ultravioleta não é transferida com o máximo de eficiência de uma substância a outra como a energia térmica ou elétrica. | |||
A existência de níveis de energia característicos para as diferentes substâncias químicas é útil para a sua identificação por meio da análise de [[raia espectral|linhas espectrais]]. Diferentes tipos de espectros são frequentemente utilizados em espectroscopia, por exemplo, o [[infravermelho]] e [[microonda]]s. A espectroscopia também é utilizada para identificar a composição de objetos remotos - como [[estrela]]s e [[galáxia]]s distantes - analisando os seus espectros de radiação. | |||
[[Ficheiro:Emission spectrum-Fe.svg|thumb|500px|center|[[Espectro de emissão]] do [[ferro]]]] | |||
== Química Inorgânica == | |||
{{artigo principal|Química inorgânica}} | |||
[[Imagem:Periodic table.svg|thumb|250px|direita|A química inorgânica estuda todos os elementos da [[tabela periódica]] e alguns compostos de carbono. A química orgânica dedica-se especialmente ao estudo dos compostos de carbono.]] | |||
Química Inorgânica é o campo da química que estuda a estrutura, reatividade e preparação dos [[composto inorgânico|compostos inorgânicos]] e [[organometálico]]s. Este domínio abrange todos os compostos químicos, com exceção dos compostos orgânicos, que são temas de estudo da Química Orgânica. A distinção entre as duas disciplinas está longe de ser absoluta e há muita sobreposição, especialmente na disciplina [[química organometálica|Química Organometálica]]. A Química Inorgânica tem aplicações em todos os aspectos da [[indústria química]], incluindo [[catálise]], [[ciência dos materiais]], [[pigmento]]s, [[surfactante]]s, [[revestimento]]s, [[medicamento]]s, [[combustível|combustíveis]] e [[agricultura]].<ref>{{citar web|publicado=American Chemical Society|título=Careers in Chemistry: Inorganic Chemistry|url=http://portal.acs.org/portal/acs/corg/content?_nfpb=true&_pageLabel=PP_ARTICLEMAIN&node_id=1188&content_id=CTP_003393&use_sec=true&sec_url_var=region1&__uuid=2fe23bbd-4dcd-4087-b35c-3a886576a618|língua=en|acessodata=14 de janeiro de 2013|arquivourl=https://web.archive.org/web/20121029023510/http://portal.acs.org/portal/acs/corg/content?_nfpb=true|arquivodata=29 de outubro de 2012|urlmorta=yes}}</ref> | |||
=== Classificação dos compostos inorgânicos === | |||
[[Imagem:Coordinate Covalent Bonding.svg|thumb|180px|left|Uma dos conceitos para explicar a basicidade ou acidez de um composto é a [[Ácido de Lewis|Teoria de Lewis]]. Na figura é ilustrado a reação de protonação de uma molécula de [[amônia]]: o par de elétrons livre do átomo de nitrogênio é "doado" ao íon hidrogênio para formar o íon amônio, caracterizando deste modo a amônia como uma base de Lewis.]] | |||
Os compostos inorgânicos são classificados em quatro grandes grupos: os [[sal|sais]], os [[óxido]]s, os [[ácido]]s e as [[Base (química)|bases]]. Os sais são constituídos de um [[cátion]] e um [[ânion]] unidos por uma [[ligação iônica]], como por exemplo o [[brometo de sódio]] NaBr, que é constituído de um cátion Na<sup>+</sup> e um ânion de brometo Br<sup>−</sup>. Os sais são caracterizados por um alto ponto de fusão e são maus [[Condutividade elétrica|condutores de eletricidade]] no [[sólido|estado sólido]]. Outras características importantes são a [[solubilidade]] em água e a facilidade de [[cristalização]]. Alguns sais (por exemplo NaCl) são muito [[solubilidade|solúveis]] em água e outros (por exemplo [[sulfato de bário|BaSO<sub>4</sub>]]) não o são. | |||
Um óxido é um composto químico que contém pelo menos um átomo de oxigênio e um outro elemento químico em sua [[fórmula química]]. Óxidos de metais contêm tipicamente um ânion de oxigênio no [[estado de oxidação]] de -2. A maior parte da [[crosta terrestre]] é constituída de óxidos sólidos, resultado de elementos que são oxidados pelo oxigênio no ar ou dissolvido na água. A combustão de hidrocarbonetos produz os dois principais óxidos de carbono: [[monóxido de carbono]] e [[dióxido de carbono]]. | |||
A [[Teoria ácido-base de Brønsted-Lowry|teoria de Brønsted-Lowry]] define como bases como aceitadores de íons de hidrogênio, enquanto a [[Reação ácido-base#Definição de Lewis|teoria de Lewis]] define bases como doadores de par de elétrons. A teoria mais antiga é a de [[Reação ácido-base#Definição de Arrheniusteoria de Arrhenius|Arrhenius]], que define bases como espécies que liberam ânion [[hidróxido]] quando em solução e é estritamente aplicável aos [[alcalinidade|compostos alcalinos]]. | |||
A definição para ácidos segue o raciocínio contrário da definição de base. A teoria de Brønsted-Lowry define como ácidos substâncias que doam íons hidrogênio, enquanto a teoria mais geral de Lewis define ácidos como aceitadores de par de elétrons. A teoria de Arrhenius define como ácidos espécies que liberam íons hidrogênio em solução aquosa. | |||
{{clr}} | |||
=== Química de Coordenação === | |||
[[Imagem:Fe(CO)5.png|thumb|180px|esquerda|[[Pentacarbonilo de ferro]]: exemplo estrutural de um composto de coordenação contendo um metal de transição (ferro) e ligantes (monóxido de carbono).]] | |||
Os [[composto de coordenação|compostos de coordenação]] tradicionais apresentam metais ligados a pares de elétrons que se encontram nos átomos dos [[ligante|grupos ligantes]], tais como H<sub>2</sub>O, NH<sub>3</sub>, Cl<sup>−</sup> e CN<sup>−</sup>. Em compostos de coordenação modernos quase todos os compostos orgânicos e inorgânicos podem ser utilizados como ligantes. O metal é geralmente um [[Grupo (química)|metal dos grupos 3-13]], assim como os ''trans''-[[lantanídeo]]s e ''trans''-actinídeos. A [[estereoquímica]] dos complexos de coordenação pode ser muito rica, como sugerido por [[Composto de coordenação#Teoria de Werner|Alfred Werner]] após a separação de dois [[enantiômero]]s de [[hexol|[Co((OH)<sub>2</sub>Co(NH<sub>3</sub>)<sub>4</sub>)<sub>3</sub>]<sup>6+</sup>]], uma manifestação precoce de que a [[quiralidade (química)|quiralidade]] não é inerente aos compostos orgânicos. Um tema dentro deste tópico é a [[química supramolecular|química supramolecular de coordenação]].{{harvRef|Lehn|1995}} | |||
Exemplos de compostos de coordenação: [Co([[EDTA]])]<sup>−</sup>, [[Cloreto de hexaminocobalto(III)|[Co(NH<sub>3</sub>)<sub>6</sub>]<sup>3+</sup>]], [[tetracloreto de titânio|TiCl<sub>4</sub>]]([[THF]])<sub>2</sub>. | |||
Os principais elementos da [[tabela periódica]] estão nos grupos da 1, 2 e 13-18 (excluindo o hidrogênio), mas devido à sua reatividade, os elementos do grupo 3 ([[escândio|Sc]], [[Ítrio|Y]], [[Lantânio|La]]) e do grupo 12 ([[Zinco|Zn]], [[Cádmio|Cd]] e [[Mercúrio (elemento químico)|Hg]]) são também geralmente incluídos entre os principais. | |||
Principais compostos de grupo | |||
Compostos do grupo principal são conhecidos desde os primórdios da química como o [[enxofre|enxofre elementar]] e o [[fósforo branco]]. Experimentos com oxigênio, O<sub>2</sub>, realizados por [[Lavoisier]] e [[Joseph Priestley|Priestley]] não só identificou um gás diatômico importante, mas abriu o caminho para descrever compostos e reações de acordo com [[estequiometria|razões estequiométricas]]. A descoberta de uma [[síntese da amônia]] bastante prática usando catalisadores de [[ferro]] por [[Carl Bosch]] e [[Fritz Haber]] no início de 1900 impactou a humanidade profundamente, demonstrando a importância da síntese inorgânica. Típicos compostos do grupo principal são SiO<sub>2</sub>, SnCl<sub>4</sub>, e N<sub>2</sub>O. Muitos compostos do grupo principal pode também ser classificados como "organometálicos", uma vez que contêm grupos orgânicos, por exemplo, B(CH<sub>3</sub>)<sub>3</sub>). Os compostos do grupo principal também ocorrem na natureza, por exemplo, fosfato de [[DNA]] e, portanto, podem ser classificados como [[química bioinorgânica|bioinorgânicos]]. Por outro lado, os compostos orgânicos que não estão ligados a hidrogênio são classificados como compostos inorgânicos, tais como os [[fulereno]]s e os óxidos de carbono. | |||
Os compostos que contêm metais do grupo 4 a 11 são considerados compostos de [[metal de transição|metais de transição]]. Alguns compostos de um metal do grupo 3 ou 12 são, por vezes, também incorporadas neste grupo, mas também muitas vezes classificados como compostos do grupo principal. Compostos de metais de transição mostram uma química de coordenação rica, variando de [[Geometria molecular|tetraedro]]s de [[titânio]] (por exemplo, TiCl<sub>4</sub>) à [[Geometria molecular|geometria quadrado planar]] de alguns complexos de [[níquel]] e complexos de coordenação octaédrica para compostos de [[cobalto]]. Uma gama de metais de transição podem ser encontrados em compostos biologicamente importantes, tais como o [[ferro]] na [[hemoglobina]]. | |||
Exemplos de composto contendo metais de transição: [[pentacarbonilo de ferro]] e [[cisplatina]]. | |||
== Química Analítica == | |||
{{Artigo principal|Química analítica}} | |||
'''Química Analítica''' é um ramo da Química que visa estudar a composição química de um material ou de uma [[amostra (material)|amostra]], usando [[metodologia|métodos]] laboratoriais. É dividida em [[análise quantitativa|Química Analítica Quantitativa]] e [[análise qualitativa|Química Analítica Qualitativa]]. A busca por métodos de análise mais rápidos, seletivos e sensíveis também é um dos objetivos essenciais da Química Analítica. Na prática, é difícil encontrar um método de análise que combinem essas três características e, em geral, qualquer uma delas pode ser suprimida em benefício de outra. | |||
=== Química Analítica Quantitativa === | |||
{{artigo principal|Análise quantitativa}} | |||
[[Ficheiro:Titolazione.gif|esquerda|thumb|200px|Em destaque, um processo de [[titulação]] com base em uma neutralização: as gotas do titulante que está na [[bureta (instrumento)|bureta]] caem na solução do [[analito]] contida no [[Erlenmeyer (balão)|Balão de Erlenmeyer]]. Um [[indicador de pH|indicador ácido-base]] presente nesta última solução mudará de cor de forma permanente, ao atingir o ponto final da titulação.]] | |||
Em Química, análise quantitativa é a determinação da abundância relativa ou absoluta (muitas vezes expressa como uma [[Concentração (química)|concentração]]) de uma, várias ou todas as substâncias presentes em uma amostra. Vários métodos foram desenvolvidos para este tipo de análise, dentre elas a [[análise gravimétrica]] e a [[titulação|análise volumétrica]]. A análise gravimétrica descreve um conjunto de métodos para a determinação da quantidade de um [[analito]] com base na massa sólida. Um exemplo simples é a determinação da quantidade de sólidos em suspensão em uma amostra de água: um volume conhecido de água é [[filtração|filtrado]] e os sólidos recolhidos no filtro são então pesados.<ref name="isbn0-03-005938-0">{{citar livro |autor =Holler, F. James; Skoog, Douglas A.; West, Donald M. |título=Fundamentals of analytical chemistry |publicado=Saunders College Pub |local=Philadelphia |ano=1996 |isbn=0-03-005938-0 }}</ref><ref>{{citar livro |autor =Hulanicki A. |título=Reactions of Acids and Bases in Analytical Chemistry |publicado=Horwood |ano=1987 |isbn=0-85312-330-6}}</ref> A análise gravimétrica fornece dados precisos sobre a composição de uma amostra e seu tempo de execução pode ser elevado. Já a análise volumétrica, por outro lado, é rápida e os resultados são na maioria dos casos satisfatórios: essas análises consistem basicamente em processos de [[titulação]], também conhecido como titulometria, onde são monitorados os volumes usados nestas etapas. Um reagente, chamado o titulante é preparado como uma solução padrão. Uma concentração conhecida e volume de titulante reage com uma solução de [[analito]] ou de titulante, para determinar a concentração. Análise volumétrica pode ser simplesmente uma [[titulação]] com base numa [[salificação|reação de neutralização]], mas também pode ser uma [[precipitação (química)|precipitação]] ou uma reação de formação de um [[composto de coordenação|complexo]], bem como a titulação com base em uma [[reação redox]]. No entanto, cada método de análise quantitativa tem uma especificação geral, em neutralização, por exemplo, a reação que ocorre é entre um ácido e uma base, a qual produz um sal e [[água]], daí o nome de neutralização. Nas reações de precipitação, a [[solução padrão]] é na maioria dos casos de [[nitrato de prata]], que é usada para reagir com os íons presentes na amostra no intuito de formar um precipitado insolúvel. Métodos de precipitação são muitas vezes chamado simplesmente de [[argentometria]]. Nos dois outros métodos, a situação é a mesma. A titulação de formação de um complexo é uma reação que ocorre entre os íons de um metal e uma solução padrão que contem na maioria dos casos, o [[EDTA]] (ácido etilenodiaminotetra-acético). Em uma titulação redox, a reação é ocorre entre um agente oxidante e um agente redutor. | |||
=== Química Analítica Qualitativa === | |||
{{artigo principal|Análise qualitativa}} | |||
[[Ficheiro:FlammenfärbungLi.png|thumb|90px|direita|[[Teste da chama]]: sais contendo o metal [[lítio]] apresentam cor avermelhada quando em contato com chama.]] | |||
Enquanto a análise quantitativa se preocupa em determinar a quantidade de determinada(s) substância(s) em uma amostra, a análise qualitativa usa diversas metodologias clássicas que visam especificar a composição elementar de compostos inorgânicos. É focada principalmente em detectar íons em uma solução aquosa: então para que materiais sólidos sejam analisados, estes devem preferencialmente serem convertidos em soluções, geralmente por um processo denominado [[digestão (química)|digestão]]. A solução é então tratada com diversos reagentes para testar a reações características de determinados íons, que podem causar mudança da cor da solução em análise, formação de precipitado ou outras mudanças visíveis.<ref name=King>E. J. King "Qualitative Analysis and Electrolytic Solutions" 1959, Harcourt, Brace, and World, New York.</ref> De acordo com as suas propriedades, os cátions são classificados em seis grupos. Cada grupo possui um reagente de comum que pode ser utilizado para separá-los a partir da solução. Para se obter resultados significativos, a separação segue uma sequência específica chamada [[marcha analítica]]. Outra importante técnica usada para identificar cátions metálicos é o [[teste da chama]]: esse procedimento se baseia no espectro de emissão característico para cada elemento, quando em contato com chama. O teste envolve a introdução da amostra em chama e a observação da cor resultante. As amostras geralmente são manuseadas com um [[fio de platina]] previamente limpo com [[ácido clorídrico]] para retirar resíduos de analitos anteriores. O teste de chama é baseado no fato de que quando uma certa quantidade de energia é fornecida a um determinado elemento químico (no caso da chama, energia em forma de calor), alguns elétrons da última [[camada de valência]] absorvem esta energia passando para um nível de energia mais elevado, produzindo o que chamamos de [[estado excitado]]. Quando um desses elétrons excitados retorna ao [[estado fundamental]], ele libera a energia recebida anteriormente em forma de radiação. Cada elemento libera a radiação em um [[comprimento de onda]] característico, pois a quantidade de energia necessária para excitar um elétron é única para cada elemento. A radiação liberada por alguns elementos possui comprimento de onda na faixa do [[espectro visível]], ou seja, o olho humano é capaz de enxergá-los através de [[cor]]es. Assim, é possível identificar a presença de certos elementos devido à cor característica que eles emitem quando aquecidos numa chama. | |||
== Físico-Química == | |||
{{Artigo principal|Físico-química}} | |||
Físico-Química é o estudo das propriedades físicas e químicas da matéria, incluindo fenômenos macroscópicos, [[átomo|atômicos]] e [[Partícula subatômica|subatômicos]], sob a ótica das leis e conceitos da [[física]]. A Físico-Química aplica os princípios, práticas e conceitos da física como [[cinemática|movimento]], [[energia]], [[força]], [[tempo]], [[termodinâmica]], [[mecânica quântica]], [[mecânica estatística]] e [[dinâmica]] para explicar fenômenos químicos. | |||
=== Disciplinas da Físico-Química === | |||
A Físico-Química pode ser subdividida em diversas disciplinas. Dentre estas, podem ser citadas a [[química quântica|Química Quântica]] (estuda e estrutura da matéria em escala atômico-molecular e a interação da luz eletromagnética com a matéria), a [[termodinâmica química|Termodinâmica Química]] (estuda em escala macroscópica o ganho e perda de energia em transformações da matéria, bem como a relação com espontaneidade de processos e equilíbrio de sistemas), a [[cinética química|Cinética Química]] (estuda a velocidade de processos, físicos ou químicos), e a [[mecânica estatística|Mecânica Estatística]] (estuda a relação entre quantização de energia e propriedades macroscópicas de sistemas e processos através de distribuição estatística). Subdisciplinas como [[Eletroquímica]], Química de Superfícies, Termoquímica, e Química de Sistemas Coloidais podem ser enquadradas dentro da Termodinâmica, enquanto a Espectroscopia dentro da Química Quântica. | |||
[[Imagem:Melting icecubes.gif|thumb|200px|direita|A [[termodinâmica química]] estuda as causas e os efeitos de mudanças de [[temperatura]], [[pressão]] e [[volume]] em sistemas químicos. Em destaque o derretimento do [[gelo]] - um exemplo de aumento de [[entropia]].]] | |||
A Química Quântica é um ramo da Físico-Química cujo foco principal é a aplicação dos conceitos da mecânica quântica a modelos físicos e experimentais de sistemas químicos. Uma das ferramentas mais usadas nestes estudos é a espectroscopia, por meio do qual a informação sobre a [[Quantização (física)|quantização]] de energia em escala molecular pode ser obtida. Os métodos espectroscópicos mais comuns são a [[espectroscopia de infravermelho]] (IV) e de [[espectroscopia de ressonância magnética nuclear|ressonância magnética nuclear]] (RMN). Os estudos em Química Quântica são bastante teóricos e os trabalhos possuem grande interface com a [[química computacional|Química Computacional]], visando a calcular as previsões da teoria quântica às espécies poliatômicas. Esses cálculos são realizados em computadores. Com estes meios, os químicos quânticos investigam aspectos envolvidos em reações química como o [[estado fundamental]] e [[Estado excitado|excitado]] de átomos em moléculas e o [[estado de transição]] que ocorre durante as reações químicas. Os objetivos principais de Química Quântica incluem o aumento da exatidão dos resultados para pequenos sistemas moleculares e o processamento de moléculas de maiores dimensões, o qual é limitado por um motivo: o tempo de cálculo aumenta quanto maior for o número de átomos de uma molécula. | |||
Outro conjunto de questões importantes giram em torno da espontaneidade das reações químicas e e quais as propriedades de uma mistura de compostos químicos. Esses aspectos são estudados pela [[termodinâmica química|Termodinâmica Química]], que prevê a possibilidade de uma reação prosseguir, a quantidade de energia que pode ser convertida em [[trabalho (física)|trabalho]] e o estudo de propriedades tais como o [[coeficiente de dilatação térmica]], a [[entropia|variação de taxa de entropia]] de um gás ou de um líquido.{{harvRef|Landau|1980|p=52}} A Termodinâmica clássica está mais preocupada com os sistemas em equilíbrio e as mudanças reversíveis. | |||
A ideia fundamental da [[cinética química|Cinética Química]] é a existência de um [[estado de transição]] de energia elevada quando [[reagente]]s são convertidos em [[produto (química)|produtos]], ou seja uma barreira energética.{{harvRef|Schmidt|2005|p=30}} De um modo geral, quanto maior for esta barreira energética, mais lenta será a reação. A segunda ideia fundamental é de que a maioria das reações químicas ocorrem como uma sequência de reações elementares,{{harvRef|Schmidt|2005|p=25; 32}} cada uma com seu próprio estado transição. As questões principais da cinética química incluem como a velocidade de uma reação depende da temperatura e das concentrações dos reagentes e de catalisadores na mistura reacional, bem como a forma como os catalisadores e condições de reação podem ser manipuladas para otimizar a taxa de reação. | |||
[[Imagem:Diferentes Pilhas AA.JPG|thumb|180px|esquerda|Um dos alvos de estudo da [[eletroquímica]], as [[pilha]]s são dispositivos que utilizam reações de oxirredução para geração de energia elétrica.]] | |||
A medida de quão rápida uma reação pode ocorrer pode ser especificada com apenas poucas amostragens da concentrações e pelo monitoramento da temperatura, ao invés de medir todas as posições e velocidades de cada molécula em uma mistura. Esse é um caso especial de um outro conceito fundamental em Físico-Química: a Mecânica Estatística.{{harvRef|Chandler|1987|p=54}} A Mecânica Estatística estuda o comportamento de sistemas com elevado número de entidades constituintes a partir do comportamento destas entidades. Os constituintes podem ser átomos, moléculas, íons, entre outros. | |||
A Eletroquímica é um ramo da Termodinâmica Química que estuda reações químicas que ocorrem em uma solução envolvendo um [[eletrodo]] (um metal ou um [[semicondutor]]) e um condutor iônico (em geral uma [[eletrólito|solução eletrolítica]]), envolvendo trocas de elétrons entre o eletrodo e o eletrólito. Esse campo científico abrange todos os processos químicos que envolvam transferência de elétrons entre substâncias, logo, a transformação de [[energia química]] em [[energia elétrica]]. Quando tal processo ocorre, produzindo transferência de elétrons, produzindo espontaneamente corrente elétrica quando ligado a um circuito elétrico, ou produzindo diferença de potencial entre dois pólos, é chamado de [[pilha]] ou [[bateria (química)|bateria]] (que muitas vezes é formada de diversas células). Quando tal processo é proporcionado, induzido, pela ação de uma corrente elétrica de uma fonte externa, este processo é denominado de [[eletrólise]]. | |||
== Química Orgânica == | |||
{{Artigo principal|[[Química orgânica]]}} | |||
A Química Orgânica é uma especialidade dentro da química que envolve o estudo científico da estrutura, propriedades, composição, reações e preparação (por síntese ou por outros meios) de compostos contendo [[carbono]] e seus derivados. Estes compostos podem conter átomos outros elementos, incluindo o [[hidrogênio]], [[nitrogênio]], [[oxigênio]], além de [[halogênio]]s, [[fósforo]], [[silício]] e [[enxofre]].{{harvRef|Morrison|1992}}{{harvRef|Morrison|1964}}<ref>Richard F. and Sally J. Daley, ''Organic Chemistry'', Online organic chemistry textbook. [http://www.ochem4free.info Ochem4free.info]</ref> Compostos orgânicos formam a base de toda a [[vida]] [[Terra|terrena]] e são estruturalmente bastante diversificados. A gama de aplicação de compostos orgânicos é enorme, sendo os principais componentes de muitos produtos, como [[plástico]]s, [[medicamento]]s, [[petroquímico|produtos petroquímicos]], [[alimento]]s, [[explosivo|materiais explosivos]] e [[tintas]]. | |||
=== Cromatografia e identificação estrutural === | |||
[[Imagem:HWB-NMR - 900MHz - 21.2 Tesla.jpg|thumb|180px|esquerda|[[Espectroscopia de ressonância magnética nuclear|Espectrometria de ressonância magnética nuclear]]: uma das diversas técnicas utilizadas para a identificação estrutural de um composto orgânico.]] | |||
Os compostos orgânicos naturais ou mesmo produtos sintéticos estão muitas vezes em misturas e uma variedade de técnicas foram desenvolvidas para avaliar a pureza e separar uma substância da outra. As técnicas mais modernas para separação e análise de amostras orgânicas são a [[cromatografia líquida de alta eficiência]] e [[cromatografia gasosa]]. Os métodos tradicionais de separação incluem a [[cristalização]], [[destilação]], [[Extração líquido-líquido|extração com solvente]] e por [[cromatografia em coluna]]. A [[espectroscopia de ressonância magnética nuclear]] (RMN) é a técnica mais habitualmente utilizada para a determinação da estrutura de compostos orgânicos e permite a atribuição completa da conectividade dos átomos e mesmo a [[estereoquímica]]. Outros métodos bastante usados para a análise de compostos orgânico são a [[espectrometria de massa]] e a [[cristalografia]]. Técnicas como a [[análise elementar]],a [[espectroscopia de infravermelho]], [[Substância opticamente ativa|rotação óptica]] e a [[espectroscopia UV/visível]] fornecem dados complementares, não sendo usadas isoladamente para determinação estrutural. | |||
=== Propriedades físicas === | |||
As propriedades físicas dos compostos orgânicos incluem tanto aspectos quantitativos quanto qualitativos. Informação quantitativas incluem o [[ponto de fusão]], [[ponto de ebulição]] e [[índice de refração]]. As propriedades qualitativas incluem [[odor]], [[solubilidade]], [[consistência]] e [[cor]]. Os compostos orgânicos, quando comparados aos inorgânicos, possuem baixo ponto de fusão e ebulição, sendo estes valores correlacionados diretamente à polaridade das moléculas e ao seu [[peso molecular]]. Alguns compostos orgânicos, especialmente os simétricos, [[sublimação|sublimam]], isto é eles evaporam sem passar pelo estágio de fusão. Um exemplo bem conhecido de um composto orgânico sublimável é [[1,4-Diclorobenzeno|para-diclorobenzeno]]. Compostos orgânicos não são geralmente muito estáveis a temperaturas acima de 300 °C, apesar de algumas exceções existirem. Os compostos orgânicos tendem a ser hidrofóbicos, isso é, elas são menos solúveis em [[água]] do que em solventes orgânicos. As exceções incluem compostos orgânicos que contêm grupos ionizáveis, bem como álcoois de baixo peso molecular, aminas e ácidos carboxílicos em que ocorrem a [[ligação de hidrogênio]]. | |||
=== Nomenclatura e estrutura === | |||
[[Imagem:Camphor structure.png|thumb|140px|direita|A estrutura da cânfora, uma substância orgânica, representada por fórmula de linha.]] | |||
A nomenclatura destes compostos seguem a sistemática estipulada pelas especificações da [[IUPAC]]. Para utilizar a nomenclatura sistemática, deve-se reconhecer a estrutura principal e os substituintes. Nomes não sistemáticos são comuns para moléculas complexas, especialmente para [[produto natural|produtos naturais]]. Assim, a [[LSD|dietilamida do ácido lisérgico]] ou LSD, desta modo informalmente chamado, é sistematicamente denominado (6a''R'',9''R'')-''N'',''N''-dietil-7-metil-4,6,6a,7,8,9-hexahidroindolo-[4,3-''fg'']-quinolina-9-carboxamida. As moléculas orgânicas são descritas por [[fórmula estrutural|fórmulas estruturais]], combinações de desenhos e [[símbolo químico|símbolos químicos]]. A fórmula de linha é bastante utilizada para representar as molecular orgânicas por ser simples e não ambígua. Neste sistema, os pontos de extremidade e os cruzamentos de cada linha representa um átomo de carbono e os átomos de hidrogênio podem ser notados ou explicitamente assumida para estar presente como implícito no carbono [[valência (química)|tetravalente]]. | |||
O conceito de [[grupo funcional|grupos funcionais]] é central na química orgânica, tanto como um meio para classificar estruturas e como para a previsão de suas propriedades físico-químicas. Um grupo funcional é um módulo molecular, e a reatividade de um determinado grupo funcional, dentro de certos limites, é semelhante em diferentes moléculas. As moléculas são classificadas com base em seus grupos funcionais. Álcoois, por exemplo, possuem sempre a subunidade C-OH. Os hidrocarbonetos alifáticos são subdivididos em três grupos de séries homólogas de acordo com seu estado de saturação: parafinas ou [[alcano]]s, não possuem quaisquer [[ligação dupla|ligações duplas]] ou [[ligação tripla|triplas]]; olefinas ou [[alceno]]s, contêm uma ou mais ligações duplas e os [[alcino]]s têm uma ou mais ligações triplas. As outras moléculas são classificadas de acordo com os grupos funcionais presentes: [[álcool]], [[ácido carboxílico]], [[éter]], [[éster]], [[aminas]], [[amida]] entre outros. Compostos saturados e insaturados existem também como estruturas cíclicas. Os anéis mais estáveis contêm cinco ou seis átomos de carbono. Outra importante classe de compostos orgânicos são os aromáticos: o [[benzeno]] é a substância mais conhecida, simples e estável. Estes hidrocarbonetos aromáticos contém diversas ligações duplas conjugadas e que obedecem ao [[Aromaticidade|modelo]] postulado por Kekulé. Outra importante propriedade do carbono é que formam cadeias, ou redes, que são ligados por ligações carbono-carbono. Esse processo de ligação é chamado de [[polimerização]], ao passo que as cadeias ou redes, são chamadas [[polímero]]s. O composto de origem é chamado um [[monómero]]. Dois grupos principais de polímeros existem: polímeros sintéticos e biopolímeros. Os polímeros sintéticos são artificialmente produzido e são comumente referidos como polímeros industriais.<ref>"chemistry of industrial polymers", [[Encyclopædia Britannica]] (2006)</ref> | |||
=== Reações em Química Orgânica === | |||
[[reação orgânica|Reações orgânicas]] são reações químicas envolvendo compostos orgânicos. A teoria geral dessas reações envolve conceitos de [[afinidade eletrônica]] do átomo-chave, [[efeito estérico|impedimento estérico]], [[ácido-base]] e [[Intermediário (química)|intermediários reativos]]. Os tipos de reação básicos são: [[reação de adição|reações de adição]], [[eliminação|reações de eliminação]], [[reação de substituição|reações de substituição]], [[reação pericíclica|reações pericíclicas]], [[Reação de transposição|reações de rearranjo]] e [[reação redox|reações redox]]. Cada reação possui um [[mecanismo de reação]] passo a passo que explica como acontece a sequência reacional, embora a descrição detalhada de alguns passos nem sempre é clara a partir de uma lista de reagentes isolados. O curso passo a passo de qualquer mecanismo de reação pode ser representado usando setas curvas, que indicam a movimentação de elétrons entre os reagentes, intermediários e produtos finais. | |||
[[Imagem:JupiterccnetcomSN2.jpg|thumb|450px|center|Mecanismo de uma [[reação de substituição]] utilizando setas: representação do movimento de pares de elétrons.]] | |||
A Química Orgânica aplicada é chamada de [[síntese orgânica|Química Orgânica sintética]]. A síntese de um novo composto é normalmente uma tarefa de resolução de problemas. Os compostos são sintetizados seguindo uma [[rota sintética]], onde a molécula ganha forma depois de várias etapas de conexão de moléculas menores. A prática de criar novas vias sintéticas para moléculas complexas é chamada de [[síntese total]]. Devido a complexidade e a utilização de reagente muitas vezes caros, é necessário um adequado planeamento de cada etapa reacional, sempre visando o máximo rendimento possível. | |||
== Bioquímica == | |||
{{Artigo principal|Bioquímica}} | |||
'''Bioquímica''' é a [[ciência]] que estuda os processos químicos que ocorrem nos [[organismos]] vivos. De maneira geral, ela consiste do estudo da estrutura e [[metabolismo|função metabólica]] de [[células|componentes celulares]] e [[vírus|virais]], como [[proteínas]], [[enzimas]], [[carboidratos]], [[lipídios]], [[ácidos nucléicos]] entre outros.<ref name="Lehninger">Lehninger, A.L.; Nelson, D.L.; Cox, M.M. (2007) ''Lehninger: Princípios de Bioquímica'', 4a. Edição, Editora Sarvier.</ref><ref name="Voet">Voet, D.; Voet, J.G. (2008) ''Fundamentos de Bioquímica - A Vida em Nível Molecular'', 2a. Edição, Editora Artmed.</ref>{{harvRef|Stryer|2004}} | |||
=== Bioquímica Estrutural === | |||
<div class="thumb tleft" style="background:#f9f9f9; border:1px solid #ccc; margin:0.5em;"> | |||
{| border="0" border="0" cellpadding="2" cellspacing="0" style="width:230px; font-size:85%; border:1px solid #ccc; margin:0.3em;" | |||
|- | |||
|[[Ficheiro:Base pair GC.svg|250px]] | |||
|} | |||
{| border="0" border="0" cellpadding="2" cellspacing="0" style="width:230px; font-size:85%; border:1px solid #ccc; margin:0.3em;" | |||
|- | |||
|[[Ficheiro:Base pair AT.svg|250px]] | |||
|} | |||
<div style="border: none; width:281px;"><div class="thumbcaption">A Bioquímica estrutural, como o nome diz, estuda os aspectos estruturais das [[biomolécula]]s. A figura ilustra o pareamento entre as bases [[guanina]] (G) e [[citosina]] (C), e entre [[timina]] (T) e [[adenina]] (A), em uma molécula de [[ácido desoxirribonucleico]] (DNA), por [[ligação de hidrogênio|ligações de hidrogênio]].</div></div></div> | |||
Esse ramo da Bioquímica preocupa-se em estudar os aspectos estruturais das biomoléculas. As quatro principais classes de biomoléculas são os [[carboidrato]]s, os [[lípido]]s, as [[proteína]]s e os [[ácido nucleico|ácidos nucleicos]]. Muitas moléculas biológicas são polímeros: neste terminologia, os monômeros são micromoléculas relativamente pequenas que estão ligadas em conjunto para gerar estas grandes macromoléculas. Diferentes macromoléculas podem reunir-se em complexos maiores, muitas vezes necessários para a [[atividade biológica]]. Os carboidratos, por exemplo, são constituídos de diversos monômeros chamados [[monossacarídeo]]s. Alguns destes monossacáridos incluem a [[glicose]] (C<sub>6</sub>H<sub>12</sub>O<sub>6</sub>), a [[frutose]] (C<sub>6</sub>H<sub>12</sub>O<sub>6</sub>) e a [[desoxirribose]] (C<sub>5</sub>H<sub>10</sub>O<sub>4</sub>). Os lipídeos são biossintetizados a partir de uma molécula de [[glicerol]] combinado com outras moléculas. Os [[triglicerídeo]]s, a principal classe de lipídeos, são constituídos por uma molécula de glicerol e três moléculas de [[ácido graxo|ácidos graxos]]. Os ácidos graxos, também considerados monômeros, podem ser saturados ou insaturados. As proteínas são biomoléculas muito grandes - macro-biopolímeros - sintetizadas a partir de monômeros chamados [[aminoácido]]s. Existem 20 aminoácidos essenciais, cada um contendo um [[carboxilo|grupo carboxilo]], um [[amina|grupo amino]] e uma cadeia lateral, chamada de grupo "R". O grupo "R" varia entre os aminoácidos, o que faz com que cada um destes aminoácido seja diferente um do outro. Estas diferenças e as propriedades destas cadeias laterais influenciam imensamente a conformação tridimensional de uma proteína. Quando os aminoácidos se combinam, formam uma ligação especial chamada [[ligação peptídica]]. Estas são [[reação de desidratação|reações de desidratação]] e os produtos podem ser um [[peptídeo]] ou uma [[proteína]]. Por fim, os [[ácidos nucleicos]] são as biomoléculas envolvidas no armazenamento, transferência e tradução da informação genética: o [[DNA]] e os [[RNA]]s. Estes ácidos nucleicos possuem elevada [[massa molecular]], e contêm em sua estrutura molecular [[ácido fosfórico]], [[pentose]]s (monossacarídeo) e [[purina|bases purínicas]] e [[pirimidina|pirimidínicas]]. São portanto macromoléculas formadas por [[nucleotídeos]].<ref name="Brasil Escola">{{citar web |url=http://www.brasilescola.com/biologia/acidos-nucleicos.htm |título=Ácidos Nucleicos |acessodata=3 de novembro de 2012 |autor=Krukemberghe Fonseca |obra=R7 |publicado=Brasil Escola }}</ref> Os nucleotideos são a [[adenina]], [[citosina]], [[guanina]], [[timina]] e [[uracila]], sendo que timina é presente somente no DNA e a uracila somente no RNA. A adenina liga-se com a timina e a uracila; a guanina e citosina pode ligar apenas uma com a outra. | |||
=== Bioquímica Metabólica === | |||
A Bioquímica Metabólica estuda os processos de [[anabolismo]] e [[catabolismo]] de biomoléculas, as vias metabólicas e os processos energéticos envolvidos nestas reações químicas. Os carboidratos têm como uma de suas funções o armazenamento de energia. A glicose, dentre as biomoléculas, possui papel central como fonte de energia para a maioria das formas de vida. Os polissacarídeos de reserva são decompostos em seus monómeros: em animais, o [[glicogênio]] é degradado enzimaticamente em resíduos de glicose). A glicose é metabolizada principalmente por uma via muito importante de 10 etapas chamada [[glicólise]] ou via glicolítica. O resultado líquido desta sequencia de reações para quebrar uma molécula de glicose em duas moléculas de [[piruvato]], é a produção de duas moléculas de [[Trifosfato de adenosina|ATP]] (adenosina trifosfato), a fonte de energia das células, juntamente com dois equivalentes reduzidos sob a forma de [[NADH]]. Energia também pode ser obtida por meio de processos anaeróbicos, quando as células não contam com a presença de [[cadeia respiratória|oxigênio]] suficiente. Estes processos são denominados [[fermentação]]. Outras vias importantes são as de biossíntese e degradação de [[lipídeo]]s. A síntese de ácidos graxos envolve moléculas de [[acetil-CoA]] e subsequentemente a [[esterificação]] para a produção de [[triglicerídeo]]s, em um processo chamado de [[lipogênese]].<ref>Stryer ''et al.'', p. 634.</ref> Os ácidos graxos são sintetizados pela ação da enzima [[ácido graxo sintase]], que polimerizam e reduzem as unidades acetil-CoA. As cadeias acílicas são estendidos por um ciclo de reações que adicionam o [[acetila|grupo acetila]], reduzem-na a um álcool e desidratam-lo a um grupo alceno e depois reduzi-la novamente a um grupo alcano. Os ácidos graxos podem ser subsequentemente convertidos em triglicerídeos, que serão armazenados no [[fígado]] e no [[tecido adiposo]]. Já a degradação de lipídeos é realizada pelo processo de [[betaoxidação]] e ocorre nas [[mitocôndrias]] e/ou em [[peroxissomo]]s para gerar acetil-CoA. Para a maior parte, os ácidos graxos são oxidados por um mecanismo que é similar, mas não idêntico, a reação inversa de síntese de ácidos graxos. Ou seja, dois fragmentos de carbono são removidos sequencialmente da extremidade do ácido, após as etapas de desidrogenação, hidratação e oxidação, para formar um [[cetoácido]], que será então fragmentado em uma reação de [[tiólise]]. A acetil-CoA é então convertido em ATP, em última análise, CO<sub>2</sub>, H<sub>2</sub>O, utilizando o [[ciclo do ácido cítrico]] e a [[Cadeia respiratória|cadeia transportadora de elétrons]]. É interessante notar que por este fato, o Ciclo de Krebs pode começar em acetil-CoA, quando a gordura está sendo usado como fonte de energia quando há pouca ou nenhuma disponível. O rendimento energético da oxidação completa de uma molécula de [[ácido palmítico]], por exemplo, é de 106 moléculas de ATP.<ref>Stryer ''et al.'', pp. 625–26.</ref> Ácidos graxos insaturados e com número ímpar de átomos de carbono requerem passos adicionais para a degradação enzimática. | |||
[[Ficheiro:Beta-Oxidation4.svg|thumb|600px|centro|A Bioquímica metabólica investiga as [[via metabólica|vias metabólicas]] nos organismos vivos e analisa o consumo energético destas reações bioquímicas. A reação apresentada mostra a última etapa reacional no processo de [[betaoxidação|degradação de ácidos graxos]]: estas moléculas são degradas em uma molécula menor, chamada [[acetil CoA]], que gerará energia na forma de [[Trifosfato de adenosina|ATP]] em reações subsequentes.]] | |||
== Sonoquímica == | |||
{{Principal|Sonoquímica}} | |||
Sonoquímica é o ramo da química que estuda o uso de [[ondas sonoras]] de alta frequência ([[ultrassom|ultrassons]]) para a promoção de [[reações químicas]].<ref name="AVALIAÇÃO DO ESTADO DE OXIDAÇÃO DO NÍQUEL NO SISTEMA Ni-DMG EM PRESENÇA DE ESPÉCIES OXIDANTES.">[[Sociedade Brasileira de Química]]. [http://www.sbq.org.br/ranteriores/23/resumos/0555/ AVALIAÇÃO DO ESTADO DE OXIDAÇÃO DO NÍQUEL NO SISTEMA Ni-DMG EM PRESENÇA DE ESPÉCIES OXIDANTES.] - Clarivaldo Santos de Sousa, Zênis Novais da Rocha, Mauro Korn. Visitado em 1 de Setembro de 2015.</ref> A [[cavitação acústica]] gerada por métodos sonoquímicos<ref>{{citar web | url=https://www.youtube.com/watch?v=zV1CjcDiiGI | título=YouTube }} - Vídeo: Sonochemistry & Cavitation. {{en}} Visitado em 4 de Julho de 2018.</ref> possibilita a produção de compostos como TiO<sub>2</sub> ([[dióxido de titânio]]),<ref>{{citar web | url=https://www.youtube.com/watch?v=7FE7Ujg5b2M | título=YouTube }} - Vídeo: Síntesis de Nanopartículas de TiO2 por Sonoquímica, Parte 1. {{es}} Visitado em 4 de Julho de 2018.</ref> H<sub>2</sub>O<sub>2</sub> ([[peróxido de hidrogênio]]), [[radicais livres]] e outros.<ref name="AVALIAÇÃO DO ESTADO DE OXIDAÇÃO DO NÍQUEL NO SISTEMA Ni-DMG EM PRESENÇA DE ESPÉCIES OXIDANTES."/> | |||
== Química e sociedade == | |||
[[Ficheiro:PenicillinPSAedit.jpg|thumb|direita|180px|A química possui papel fundamental no aumento da [[expectativa de vida|expectativa]] e [[qualidade de vida]] da população mundial, pela aplicação de metodologias para descoberta, preparação e produção de uma diversidade de produtos bem como o uso racional de recursos naturais. A imagem destaca a disponibilidade de tratamento de infecções usando o antibiótico [[penicilina]] em meados da década de 1940. Nesta mesma época teve início a produção em escala industrial deste medicamento.]] | |||
A aplicação da Química aos processos industriais e o desenvolvimento de novos produtos trouxe, sem dúvida, inestimáveis benefícios a toda a [[humanidade]]. O descobrimento de medicamentos - como exemplo a [[penicilina]]<ref>{{citar web |url=http://super.abril.com.br/alimentacao/65-anos-cada-perna-437886.shtml|título=65 anos. Em cada perna|acessodata=10 de fevereiro de 2013 |autor= Carlos Dias|ano= 1999|obra=Revista Superinteressante }}</ref> e o [[paclitaxel|taxol]] - provenientes de fontes naturais e a possibilidade de obter substâncias sintéticas em laboratório - como a [[dipirona]] e o [[omeprazol]] - proporcionou alívio e a cura de diversas doenças. Consequentemente, a expectativa de vida população aumentou. Além de medicamentos, a pesquisa na área química gerou o desenvolvimento de novos [[combustível|combustíveis]], materiais como o [[polietileno]] e o [[náilon]], produtos [[cosméticos]] e de higiene pessoal, [[alimento]]s, [[petroquímico]]s, [[tinta]]s e [[verniz]]es entre outros<ref>{{Citar periódico |autor=Torresi et al.|ano=2009 |titulo=Química é uma ciência em expansão |jornal=[[Química Nova]] |volume=32 |numero= 8|issn= 0100-4042|url=http://www.scielo.br/scielo.php?pid=S0100-40422009000800001&script=sci_arttext |acessadoem=10 de fevereiro de 2013}}</ref><ref>{{citar web |url= http://super.abril.com.br/ciencia/reacoes-bom-dia-quimica-presente-atividades-dia-a-dia-439756.shtml |título= A química presente nas atividade do dia-a-dia|acessodata=10 de fevereiro de 2013 |autor= Lúcia Helena de Oliveira |ano=1991 |obra= Revista Superinteressante}}</ref> | |||
Acompanhando o desenvolvimento dos processos químicos industriais, problemas gerados pelo descarte inadequando de substâncias e produtos químicos acarretaram novos problemas, como a [[poluição ambiental]]. Diante dessas consequências indesejáveis, coube aos profissionais químicos não somente o desenvolvimento novos produtos e processos químicos eficientes, mas planejar que estes não fossem poluentes, evitando os danos causados por algumas substâncias químicas. Propostas e ações de [[remediação ambiental]], visando a correção de áreas afetadas bem como o aproveitamento racional dos recursos naturais são preocupações inerentes a estes profissionais. A profissão de [[químico]] é regulamentada e a ele são atribuídos o [[magistério]], a atuação em ambientes industriais e de pesquisa. A gama de atividades ainda envolvem o projeto, planejamento e controle de produção; desenvolvimento de produtos; operações e controle de processos químicos; saneamento básico; [[química forense]]; tratamento de resíduos industriais; segurança; gestão de meio ambiente e, em alguns casos específicos, vendas, assistência técnica, planejamento industrial e direção de empresas.<ref>[http://www.crq4.org.br/default.php?p=texto.php&c=o_que_faz_um_quimico Conselho Regional de Química - O que faz um químico?]</ref> O primeiro laboratório para ensino de Química em Portugal foi o [[Laboratório Chimico]] instalado na [[Universidade de Coimbra]]. Foi edificado em 1772 a mando do [[Marquês de Pombal]] e hoje abriga o [[Museu da Ciência da Universidade de Coimbra]].<ref>{{citar web |url=http://www.publico.pt/ciencia/noticia/laboratorio-chimico-abre-hoje-como-museu-de-ciencia-1278768|título=Laboratório Chimico abre hoje como museu de ciência|acessodata=10 de fevereiro de 2013 |autor= Teresa Firmino|data=5 de dezembro de 2006 |obra=Público }}</ref> | |||
No Brasil, a Química se tornou uma disciplina em uma série de instituições após a chegada da corte portuguesa ao país em 1808. A primeira dessas disciplinas foi ministradas em cursos existentes na [[Real Academia Militar]], fundada em 1810 no [[Rio de Janeiro (cidade)|Rio de Janeiro]] pelo príncipe regente [[João VI de Portugal]]. Devido à falta de pessoal local para o cargo de professor de Química, o químico britânico [[Daniel Gardner]] foi contratado para exercer essa função. Ele ocupou a cadeira até a sua aposentadoria, em 1825.<ref>{{Citar periódico |autor=Santos et al.|ano=2011 |titulo=O primeiro curso regular de química no Brasil|jornal=[[Química Nova]] |volume=34 |numero= 2|issn= 0100-4042|doi=dx.doi.org/10.1590/S0100-40422011000200034|url=http://www.scielo.br/scielo.php?script=sci_arttext&pid=S0100-40422011000200034 |acessadoem=10 de fevereiro de 2013}}</ref> | |||
[[Ficheiro:LaboratorioChimico.jpg|thumb|250px|esquerda|Fachada lateral do [[Laboratorio Chimico]], o primeiro centro de ensino de ciências químicas em Portugal.]] | |||
Os cursos de Química são generalistas - privilegiando a Química Orgânica, Química Inorgânica, Química Analítica, Físico-Química e Bioquímica -, com aulas teóricas e experimentais. A primeira metade do curso contempla também disciplinas como [[cálculo diferencial|Cálculo Diferencial]] e [[cálculo integral|Integral]] e [[Física]], fundamentais para aprofundamento em determinados assuntos. Muitos faculdades permitem a escolha de opções no decorrer da graduação: formação de professores de Química (com disciplinas pedagógicas e estágio em estabelecimentos de ensino); Química Básica (para os alunos que possuem interesse em pesquisa básica e/ou desejam seguir os estudos na [[pós-graduação]] e a Química Industrial (o aluno cursa um rol de disciplinas que permitem uma visão sobre operações industriais, além do estágio em indústrias). Outras faculdades oferecem a habilitação já na matrícula, como Química Industrial, Tecnológica, Ambiental, de Alimentos, Petróleo ou Têxtil.<ref>{{citar web |url=http://guiadoestudante.abril.com.br/profissoes/ciencias-exatas-informatica/quimica-688125.shtml|título=Guia Abril de Estudante - Química |acessodata=10 de fevereiro de 2013 }}</ref> Dentre as importantes sociedades científicas nas comunidades lusófonas, podem ser citadas a [[Sociedade Brasileira de Química]]<ref>{{Citar periódico |autor=Bechara & Vietler et al.|ano=1997 |titulo=Criação e consolidação da Sociedade Brasileira de Química (SBQ) | |||
|jornal=[[Química Nova]] |volume=20 |numero= especial|issn= 0100-4042|doi=dx.doi.org/10.1590/S0100-40422011000200034|url=http://www.scielo.br/scielo.php?pid=S0100-40421997000700012&script=sci_arttext |acessadoem=10 de fevereiro de 2013}}</ref> e a [[Sociedade Portuguesa de Química]].<ref>{{citar web |url=http://www.cienciahoje.pt/index.php?oid=46652&op=all|título=Cem anos de Sociedade Portuguesa de Química |acessodata=10 de fevereiro de 2013 |data=27 de dezembro de 2010 |obra=Ciência Hoje }}</ref> Essas instituições são destinadas a cuidar de assuntos de mérito da Química, em seus aspectos científicos, epistemológicos, metodológicos e pragmáticos. Essas sociedades são abertas a participação de profissionais em Química e áreas afins e atuam no desenvolvimento e consolidação da comunidade, na divulgação da Química e de suas relações, aplicações e consequências para o desenvolvimento do país e para a melhoria da qualidade de vida dos cidadãos. | |||
[[Ficheiro:Curie-nobel-portrait-2-600.jpg|thumb|180px|direita|[[Marie Curie]] foi a primeira mulher agraciada com o [[Nobel de Química]] em 1911. Cem anos depois foi comemorado o [[Ano Internacional da Química]].]] | |||
Diversas [[competições científicas]], nacionais e internacionais, foram criadas para estimular o interesse pela química no meio estudantil. Desde [[1986]], o [[Brasil]] promove a [[Olimpíada Brasileira de Química]]. A primeira [[Olimpíada Iberoamericana de Química]] foi realizada no ano de [[1995]], em [[Mendoza (Argentina)]]. Em [[1968]], a cidade de [[Praga]], na então [[República Tcheca]], sediou a primeira [[Olimpíada Internacional de Química]]. | |||
O ano de [[2011]] foi considerado o [[Ano Internacional da Química]], em resultado da reunião da [[Assembleia Geral das Nações Unidas]] (AGNU), que decorreu em 31 de julho a 6 de agosto de 2009, em [[Glasgow]], na Escócia. A agenda de comemorações foi organizada pela [[União Internacional de Química Pura e Aplicada]] (IUPAC) e pela Organização das Nações Unidas para a Educação, a | |||
Ciência e a Cultura ([[UNESCO]]). O objetivo do Ano Internacional da Química foi celebrar as contribuições da química para o bem-estar da humanidade, com ênfase à importância da química para os recursos naturais sustentáveis. Em 2011 também foi comemorado o centenário da primeira vez que o [[Prêmio Nobel de Química]] foi entregue a uma mulher, [[Marie Curie]], por suas pesquisas com [[radioisótopo]]s. Foi a primeira vez também que uma mulher ganhava uma das cinco modalidades do prêmio. Este fato motivou diversas celebração pela contribuição das mulheres à ciência durante a Ano da Química. | |||
O [[Prêmios Nobel|Prêmio Nobel]] é atribuído anualmente pela [[Academia Real das Ciências da Suécia]] a diversos [[cientista]]s de diferentes campos, entre eles a [[Nobel de Química|química]]. A premiação foi criada a partir do desejo de [[Alfred Nobel]] de galardoar personalidades que contribuíssem para o bem-estar da humanidade. Este prêmio é administrado pela [[Fundação Nobel]], adjudicado por um [[comité]] constituído por cinco membros eleitos pela [[Academia Real das Ciências da Suécia]]. O primeiro Nobel de Química foi atribuído em 1901 a [[Jacobus Henricus van 't Hoff|Jacobus Henricus van' t Hoff]], dos [[Países Baixos]], por sua descoberta das leis da dinâmica da Química e [[pressão osmótica]] em soluções.<ref>{{citar web |url=http://noticias.sapo.ao/vida/noticias/artigo/1275214.html|título=Robert J. Lefkowitz e Brian K. Kobilka ganham o prêmio Nobel da Química|acessodata=10 de fevereiro de 2013 |data=27 de dezembro de 2010 |obra=Ciência Hoje }}</ref> | |||
[[ | == Profissionais da Química == | ||
{{Principal|Químico}} | |||
No Brasil, atualmente são considerados profissionais afins da ciências químicas, com registro nos Conselhos Federais e Regionais de Química: | |||
* [[Engenharia química|Engenharia Química]] e semelhantes (Engenharia de alimentos, por exemplo); | |||
* Bacharel em [[Químico|Química]]; | |||
* Bacharel em [[Química industrial|Química Industrial]] ou Química tecnológica; | |||
* [[Bioquímico|Bacharel em Bioquímica]]; | |||
* Licenciado em Química; | |||
* Técnicos em modalidades da química; | |||
*Tecnólogos em modalidades da química, tais como Processos Químicos.<ref>{{Citar web|titulo=Tecnologia em Processos Químicos|url=http://www.utfpr.edu.br/cursos/graduacao/tecnologia/tecnologia-em-processos-quimicos|obra=Universidade Tecnológica Federal do Paraná UTFPR|acessodata=2020-05-19|lingua=pt-br}}</ref> | |||
== Ver também == | |||
{{Correlatos | |||
|wikcionário = Química | |||
|wikilivros = Química | |||
|wikiversidade = Portal:Química | |||
|wikiquote= Química | |||
}} | |||
* [[Ano Internacional da Química]] | |||
* [[Associações de Química]] | |||
* [[Chemical Abstracts]] | |||
* [[Engenharia Química]] | |||
* [[Indústria química|Indústrias químicas]] | |||
* [[Instituições de Química]] | |||
* Lista de químicos | |||
* [[Nobel de Química]] | |||
* [[Periódicos de química]] | |||
* [[Tabela periódica]] | |||
{{Notas}} | |||
{{Referências|col=2}} | |||
== Bibliografia == | |||
{{dividir em colunas}} | |||
* {{citar livro|último=Atkins|primeiro=Peter William|autorlink=Peter William Atkins|coautores=Paula, Julio de|título=Atkins' Physical Chemistry|ano=2006|editora=Oxford University Press|edição=8|página=1053|língua=en|isbn=9780716771111|url=http://books.google.com.br/books?isbn=071677111X|acessodata=14 de janeiro de 2013|ref=harv}} | |||
* {{citar livro|último=Atkins|primeiro=Peter William|autorlink=Peter William Atkins|coautores=Jones, Loretta|título=Chemical Principles: The Quest for Insight|ano=2008|editora=W.H. Freeman|edição=4|página=787|língua=en|isbn=9780716799030|ref=harv}} | |||
* {{citar livro|último=Brown|primeiro=Theodore L|coautores=Lemay, H. Eugene; Bursten, Bruce Edward; Lemay, H|título=Chemistry: The Central Science|ano=1999|editora=Prentice Hall|edição=8|língua=en|isbn=0-13-010310-1|ref=harv}} | |||
* {{citar livro|último=Brown|primeiro=Theodore L|coautores=Bursten, Bruce Edward; Kemp, Kenneth C; LeMay, Harold Eugene; Nelson, John H|título=Chemistry – the Central Science|ano=2003|local=Nova Jérsei|editora=Prentice Hall|edição=9|página=592|língua=en|isbn=9780130669971|url=http://books.google.com.br/books?id=kEAvAQAAIAAJ|acessodata=14 de janeiro de 2013|ref=harv}} | |||
* {{citar livro|último=Brown|primeiro=Theodore L|coautores=Bursten, Bruce Edward; LeMay, Harold Eugene; Murphy, Catherine J; Woodward, Patrick |título=Chemistry – the Central Science|ano=2009|local=Nova Jérsei|editora=Prentice Hall|edição=11|página=592|língua=en|isbn=0-13-236489-1|url=https://www.savvas.com/index.cfm?locator=PS34Du&PMDbSiteId=2781&PMDbSolutionId=6724&PMDbSubSolutionId=&PMDbCategoryId=811&PMDbSubCategoryId=23496&PMDbSubjectAreaId=&PMDbProgramId=150684|acessodata=14 de janeiro de 2013|ref=harv}} | |||
* {{citar livro|último=Chandler|primeiro=David|título=Introduction to Modern Statistical Mechanics|ano=1987|local=Nova Iorque|editora=Oxford University Press|página=274|língua=en|isbn=9780195042771|url=http://books.google.com.br/books?isbn=0195042778|acessodata=14 de janeiro de 2013|ref=harv}} | |||
* {{citar livro|último=Chandra|primeiro=Sulekh|título=Comprehensive Inorganic Chemistry|ano=2005|local=Nova Déli|editora=New Age Publishers|página=324|língua=en|isbn=9788122415124|url=http://books.google.com.br/books?isbn=8122415121|acessodata=14 de janeiro de 2013|ref=harv}} | |||
* {{citar livro|último=Chang|primeiro=Raymond|título=Chemistry|ano=1998|local=Nova Iorque|editora=McGraw Hill|edição=6|língua=en|isbn=0-07-115221-0|ref=harv}} | |||
* {{citar livro|último=Ebbin|primeiro=Darrell, D|título=General Chemistry|ano=1990|local=Boston|editora=Houghton Mifflin|edição=3|língua=en|isbn=0-395-43302-9|ref=harv}} | |||
* {{citar livro|último=Gibbs|primeiro=Josiah Willard|autorlink=Josiah Willard Gibbs|título=On the Equilibrium of Heterogeneous Substances|ano=1876|editora=American Journal of Science and Arts|página=458|língua=en|url=http://books.google.com.br/books?id=j-NfuAAACAAJ|acessodata=14 de janeiro de 2013|ref=harv}} | |||
* {{citar livro|último=Halal|primeiro=John|título=Milady's Hair Structure and Chemistry Simplified|ano=2008|editora=Milady Publishing|edição=5|capítulo=Chapter 8: General Chemistry|isbn=1-4283-3558-7|url=http://www.wadsworthmedia.com/marketing/sample_chapters/156253629X_ch08.pdf|acessodata=14 de janeiro de 2013|ref=harv}} | |||
* {{citar livro|último=Hill|primeiro=John W.|coautores=Petrucci, Ralph H.; McCreary, Terry W.; Perry, Scott S|título=General Chemistry|ano=2005|local=Upper Saddle River|editora=Prentice Hall|edição=4|página=1200|língua=en|isbn=9780131402836|url=http://books.google.com.br/books?isbn=0131402838|acessodata=14 de janeiro de 2013|ref=harv}} | |||
* {{citar livro|último=Laidler|primeiro=Keith James|título=The World of Physical Chemistry|ano=1993|local=Oxford|editora=Oxford University Press|página=476|língua=en|isbn=9780198555971|url=http://books.google.com.br/books?id=AtfaAAAAMAAJ|acessodata=14 de janeiro de 2013|ref=harv}} | |||
* {{citar livro|último=Landau|primeiro=Lev Davidovich|autorlink=Lev Landau|coautores=Lifshitz, E. M.; Pitaevskii, L. P|título=Statistical Physics|ano=1980|local=Nova Iorque|editora=Elsevier Butterworth Heinemann|edição=3|página=387|língua=en|isbn=9780750626361|url=http://books.google.com.br/books?isbn=0750626364|acessodata=14 de janeiro de 2013|ref=harv}} | |||
* {{citar livro|último=Lehn|primeiro=Jean-Marie|título=Supramolecular Chemistry: Concepts and Perspectives|ano=1995|local=Weinheim|editora=Wiley|página=281|língua=en|isbn=9783527293117|url=http://books.google.com.br/books?isbn=3527293116|acessodata=14 de janeiro de 2013|ref=harv}} | |||
* {{citar livro|último=Leigh|primeiro=G. J|coautores=International Union of Pure and Applied Chemistry, Commission on the Nomenclature of Inorganic Chemistry|título=Nomenclature of Organic Chemistry – Recommendations 1990|ano=1990|local=Oxford|editora=Blackwell Scientific Publications|língua=en|isbn=0-08-022369-9|ref=harv}} | |||
* {{citar livro|último=Mills|primeiro=Ian|coautores=Cvitaš, Tomislav; Kallay, Nicola; Klaus, Homann; Kuchitsu, Kozo|título=Quantities, units and symbols in physical chemistry|ano=1993|local=Oxford|editora=John Wiley & Sons|edição=2|página=166|língua=en|isbn=9780632035830|url=http://www.iupac.org/publications/books/gbook/index.html|acessodata=14 de janeiro de 2013|ref=harv|arquivourl=https://web.archive.org/web/20080218101859/http://www.iupac.org/publications/books/gbook/index.html|arquivodata=2008-02-18|urlmorta=yes}} | |||
* {{citar livro|último=Modell|primeiro=Michael|coautores=Reid, Robert C|título=Thermodynamics and Its Applications|ano=1974|local=Englewood Cliffs|editora=Prentice-Hall|edição=0-13-914861-2|língua=en|ref=harv}} | |||
* {{citar livro|último=Morrison|primeiro=Robert T|coautores=Boyd, Robert N; Boyd, Robert K|título=Organic Chemistry|ano=1992|editora=Benjamin Cummings|edição=6|língua=en|isbn=0-13-643669-2|ref=harv}} | |||
* {{citar livro|último=Pauling|primeiro=Linus|autorlink=Linus Pauling|título=General Chemistry|ano=1970|local=Nova Iorque|editora=Dover Publications|língua=en|isbn=0-486-65622-5|ref=harv}} | |||
* {{citar livro|último=Reinhardt|primeiro=Carsten|título=Chemical Sciences in the 20th Century: Bridging Boundaries|ano=2001|editora=Wiley-VCH|língua=en|ref=harv}} | |||
* {{citar livro|último=Roberts|primeiro=John D|coautores=Caserio, Marjorie C|título=Basic Principles of Organic Chemistry|ano=1964|editora=W. A. Benjamin|língua=en|ref=harv}} | |||
* {{citar livro|último=Schmidt|primeiro=Lanny D|título=The Engineering of Chemical Reactions|ano=2005|local=Nova Iorque|editora=Oxford University Press|edição=2|língua=en|isbn=0-19-516925-5|ref=harv}} | |||
* {{citar livro|último=Stryer|primeiro=L|coautores=Tymoczko, J. L.; Berg, J. M|título=Bioquímica|ano=2004|editora=Guanabara|edição=5|ref=harv}} | |||
* {{citar livro|último=Vucinich|primeiro=Alexander|título=Science in Russian culture|ano=1963|editora=Stanford University Press|língua=en|isbn=0-8047-0738-3|url=http://books.google.com/books?id=YoE1wsA6USQC&pg=PA388|acessodata=14 de janeiro de 2013|ref=harv}} | |||
* {{citar livro|último=Whitten|primeiro=Kenneth W|coautores=Davis, Raymond E; Peck, M. Larry|título=General Chemistry|ano=2000|local=Fort Worth|editora=Saunders College Publishing/Harcourt College Publishers|edição=6|língua=en|isbn=978-0-03-072373-5|ref=harv}} | |||
* {{citar livro|último=Zumdahl|primeiro=Steven S|título=Chemistry|ano=1997|local=Boston|editora=Houghton Mifflin|edição=4|língua=en|isbn=0-669-41794-7|ref=harv}} | |||
{{dividir em colunas fim}} | |||
{{química}} | |||
{{ciências-rodapé}} | |||
{{Controle de autoridade}} | |||
{{Portal3|Química}} | |||
{{DEFAULTSORT:Quimica}} | |||
[[Categoria:Química| ]] | |||
[[ | |||
Edição atual tal como às 23h03min de 25 de agosto de 2022
Química[1]Predefinição:Nota de rodapé é a ciência que estuda a composição, estrutura, propriedades da matéria, as mudanças sofridas por ela durante as reações químicas e a sua relação com a energia.[2][3] É considerada uma ciência exata e é chamada muitas vezes de ciência central porque é a ponte entre outras ciências naturaisPredefinição:HarvRefPredefinição:Nota de rodapé como Física, Matemática e Biologia. A Química possui papel fundamental no desenvolvimento tecnológico, pois a utilização dos conceitos e técnicas dessa ciência permite a obtenção de novas substâncias, além de preocupar-se com a prevenção de danos e exploração sustentável do meio ambiente.
As áreas da Química são agrupadas em quatro grandes divisões, a saber: Química Inorgânica (estuda a matéria inorgânica), Química Orgânica (estuda os compostos de carbono), Físico-Química (compreende os aspectos energéticos e cinéticos dos sistemas químicos e suas transformações em escalas macroscópicas, e atômico-molecular), e Química Analítica (analisa materiais e ajuda a compreender a sua composição e quantidade de sistemas químicos). Áreas interdisciplinares e complementares incluem Bioquímica, Ensino de Química, e Química Ambiental.
No Brasil são considerados profissionais relacionados a ciências químicas, com registro nos Conselhos Federais e Regionais de Química: Engenheiros Químicos, Bacharéis e Licenciados em Química, Bacharéis em Química Industrial ou Química Tecnológica, Bacharéis em Bioquímica.
História
O desenvolvimento desta ciência teve como base as observações de experimentos, sendo portanto, considerada uma ciência experimental
Os filósofos gregos Empédocles e Aristóteles acreditavam que as substâncias eram formadas por quatro elementos: terra, vento, água e fogo. Paralelamente, discorria outra teoria, o atomismo, que postulava que a matéria era formada por átomos, partículas indivisíveis que se podiam considerar a unidade mínima da matéria. Esta teoria, proposta pelo filósofo grego Demócrito de Abdera, não foi popular na cultura ocidental, dado o peso das obras de Aristóteles na Europa. No entanto, tinha seguidores (entre eles Lucrécio) e a ideia ficou presente até o princípio da Idade Moderna.
Entre os séculos III a.C. e o século XVI d.C., a Química estava dominada pela alquimia. O objetivo de investigação mais conhecido da alquimia era a procura da pedra filosofal, um método hipotético capaz de transformar os metais em ouro, e o elixir da longa vida. Na investigação alquímica desenvolveram-se novos produtos químicos e métodos para a separação de elementos químicos. Deste modo foram-se assentando os pilares básicos para o desenvolvimento de uma futura química experimental. O cientista irlandês Robert Boyle é tido por muitos como o iniciador da Química moderna, já que, em meados do século XVII, ele executou experimentos planejados, estabelecendo através deles generalizações. Apesar dos méritos de Boyle, muitos consideram o francês Antoine Laurent Lavoisier, que viveu no século XVIII, o pai da Química, especialmente devido ao seu trabalho sobre o conceito de conservação da massa, sendo este considerado o marco do estabelecimento da química moderna, ocasionando a chamada Revolução Química. Os estudos de Lavoisier foram referência para que fosse proposto por John Dalton, no início do século XIX, o primeiro modelo atômico. A Química experimentou grande desenvolvimento teórico e metodológico durante o século XX, especialmente pelo estabelecimento da mecânica quântica, métodos espectroscópicos e metodologias de síntese orgânica, que impulsionaram o descobrimento de novos fármacos, determinação da estrutura química de moléculas, como o ácido desoxirribonucleico e sofisticação das teorias já existentes
A separação da Alquimia
A Química, como é conhecida atualmente, começou a desenvolver-se entre os séculos XVI e XVII. Nessa época estudou-se o comportamento e propriedades dos gases estabelecendo-se técnicas de medição. Aos poucos, foi-se desenvolvendo e refinando o conceito de elemento como uma substância elementar que não podia ser descomposto em outras. Também esta época desenvolveu-se a teoria do flogisto para explicar os processos de combustão.
Robert Boyle desenvolveu sua magnum opus "O Químico Cético", abandonando as teorias aristotélicas de alquimia e contemplando a pesquisa experimental e conclusões com base em experimentos. Georg Ernst Stahl e Johann Joachim Becher desenvolveram em 1700 a teoria do flogisto. Esta teoria, que se manteve por 80 anos até ser refutada, afirmava que as substâncias suscetíveis de sofrer combustão continham o flogisto, e que o processo de combustão consistia basicamente na perda desta substância. A causa da má interpretação da teoria do flogisto era a então substância ainda desconhecida presente no ar, o oxigênio. Joseph Priestley, estudando a composição do ar, percebeu a existência de uma substância no ar, a qual participava dos processos respiratórios e promovia reações de oxidação de metais aos seus óxidos. A teoria de elementos de Boyle considerava que um elemento químico era uma pluralidade de átomos idênticos, indivisíveis.
Por volta do século XVIII, a Química adquire definitivamente as características de uma ciência experimental. Desenvolvem-se métodos de medição cuidadosos que permitem um melhor conhecimento de alguns fenómenos, como o da combustão da matéria; Antoine Lavoisier foi o responsável por perceber a presença do carbono nos seres vivos e a complexidade de suas ligações em relação aos compostos inorgânicos e refutador da teoria do flogisto, e assentou finalmente os pilares fundamentais da Química moderna.
Desenvolvimento da tabela periódica
O período seguinte foi a busca de novos elementos químicos, a determinação de seus pesos atômicos exatos e sua caracterização por reações com outras substâncias, sendo essa uma das tarefas mais importantes da Química inorgânica. Lothar Meyer e Dmitri Mendeleev ordenaram os elementos químicos por massa atômica e com base na capacidade de fazer ligações químicas, originando a tabela periódica. Svante Arrhenius, Jacobus Henricus van 't Hoff e Wilhelm Ostwald estimaram a constante de dissociação de sais, ácidos e bases em soluções aquosas. Alfred Werner questionou a validade das teorias e modelos aceitos na Química Orgânica, estruturando a nova química inorgânica em termos dos conceitos de coordenação e de estereoquímica.
Antes do século XIX, os químicos acreditavam que os compostos obtidos a partir de muitos organismos vivos eram demasiadamente complexos para serem sintetizados. De acordo com o conceito de vitalismo, a matéria orgânica era dotada de uma "força vital". Esses compostos foram nomeados como "orgânicos", porém durante a primeira metade do século XIX os cientistas descobriram que os compostos orgânicos poderiam ser sintetizados em laboratório. Em 1828, Friedrich Wöhler produziu a ureia, um componente da urina, a partir do sal inorgânico cianato de amônio e, embora Wöhler sempre tenha sido cauteloso sobre a alegação de que teria refutado a teoria da força vital, esse evento tem sido muitas vezes visto como um marco para o estabelecimento da Química Orgânica. A descoberta do petróleo e a sua separação em frações de acordo com a diferença no ponto de ebulição de seus componentes foi outra etapa importante da história da ciência. Já a indústria farmacêutica teve seu início na última década do século XIX, com a fabricação de ácido acetilsalicílico (mais conhecido por como aspirina) pela Bayer na Alemanha.[4]
Com os trabalhos sobre termodinâmica química, eletrólitos em soluções, cinética química e outros assuntos entre as décadas de 1860 a 1880, originou-se a Físico-Química moderna. O marco foi a publicação em 1876 por Josiah Willard Gibbs de seu artigo, sobre o equilíbrio de substâncias heterogêneas. Este artigo apresentou vários dos pilares da Físico-Química, como a energia livre de Gibbs, os potenciais químicos e a regra das fases de Gibbs.Predefinição:HarvRef Outros marcos incluem a introdução dos termos entalpia por Heike Kamerlingh Onnes e processos macromoleculares.
O primeiro método de análise instrumental foi desenvolvido por Robert Bunsen e Gustav Kirchhoff e foi baseado na espectroscopia de absorção atômica de chama. Utilizando essa técnica, eles descobriram, em 1860, elementos como o rubídio (Rb) e o césio (Cs).[5] Durante este período a análise instrumental tornou-se progressivamente dominante. Em particular, muitas das técnicas espectroscópicas e de espectrometria básicas foram descobertas no início do século XX e aperfeiçoadas até o final do século XX.[6] Os processos de separação se desenvolveram na linha de tempo de modo similar e também tornaram-se cada vez mais instrumentais.[7]
Bioquímica e Química Quântica
A Bioquímica, anteriormente chamada de Química Biológica ou Fisiológica,[8] surgiu a partir das investigações de fisiologistas e químicos sobre compostos e conversões químicas em seres humanos e plantas no século XIX [9][10] O termo Bioquímica foi proposto pelo químico e médico alemão Carl Neuberg (1877-1956) em 1903, embora no século XIX grandes pesquisadores, como Wohler, Liebig, Pasteur e Claude Bernard, estudassem a Química da vida sobre outras denominações.[8][11]
Com a Segunda Guerra Mundial, o mundo ingressou na era atômica, marcada pelo descobrimento dos elementos transurânicos e pelos avanços na radioquímica. A disponibilização de isótopos permitiu a realização de experimentos importantes sobre o comportamento cinético e mecanístico dos compostos inorgânicos, o qual foi racionalizado por Henry Taube, em 1949, com base nas teorias de ligação. O entendimento lógico do caráter lábil/inerte dos compostos de coordenação lançou a semente dos mecanismos de transferência de elétrons, propostos por Taube em 1953, definitivamente consagrados com o Prêmio Nobel que lhe foi outorgado em 1983.
Desde a metade do século XX, com o desenvolvimento de novas técnicas como a cromatografia, a difracção de raios X, marcação por isótopos e o microscópio eletrônico, houve avanço na área da Bioquímica. Essas técnicas abriram o caminho para a análise detalhada e a descoberta de muitas moléculas e rotas metabólicas das células, como a glicólise, ciclo de Krebs (ciclo dos ácidos tricarboxílicos) e a fosforilação oxidativa (cadeia transportadora de elétrons).
Princípios da Química moderna
Tradicionalmente, os princípios da Química se iniciam com o estudo das partículas elementares, átomos, moléculas,[12] substâncias e outros agregados da matéria. Matéria é tudo aquilo que ocupa espaço e possui massa de repouso (ou massa invariante). É um termo geral para a substância da qual todos os objetos físicos consistem.[13][14] Tipicamente, a matéria inclui átomos e outras partículas que possuem massa. A massa é dita por alguns como sendo a quantidade de matéria em um objeto e volume é a quantidade de espaço ocupado por um objeto, mas esta definição confunde massa com matéria, que não são a mesma coisa.[15] Diferentes campos usam o termo de maneiras diferentes e algumas vezes incompatíveis; não há um único significado científico que seja consenso para a palavra "matéria", apesar do termo "massa" ser bem definido. A matéria pode ser encontrada principalmente nos estados sólido, líquido e gasoso, em forma isolada ou em combinação. Reações químicas[16] e outras transformações como as mudanças de fase envolvem o rearranjo de ligações químicas e outras interações entre as moléculas. Estas transformações envolvem invariavelmente diversos conceitos importantes como energia, equilíbrio químico entre outros. A seguir serão explanados as principais entidades usadas para descrever a matéria bem como alguns conceitos que permeiam as transformações sofridas pela matéria.
Espécies químicas
O quark, na física de partículas, é uma partícula elementar e um dos dois constituintes fundamentais da matéria (o outro é o lépton). Quarks se combinam para formar partículas compostas chamadas hádrons das quais as mais estáveis desse tipo são os prótons e os nêutrons, que são os principais componentes dos núcleos atômicos. Devido a um fenômeno conhecido como confinamento de cor, os quarks nunca são diretamente observados ou encontrados de forma isolada; eles podem ser encontrados apenas nos hádrons, como os bárions (categoria a que pertencem os prótons e os nêutrons), e os mésons. Por essa razão, muito do que se sabe sobre os quarks advém da observação dos hádrons.
O átomo é a unidade básica de matéria que consiste de um núcleo denso central rodeado por uma nuvem de elétrons de carga negativa. O núcleo atômico contem prótons carregados positivamente e nêutrons eletricamente neutros (exceto o hidrogênio-1, que é o nuclídeo estável sem nêutrons). Os elétrons de um átomo interagem com o núcleo por força eletromagnética, e do mesmo modo, um grupo de átomos permanecem ligados uns aos outros por ligações químicas baseadas nesta mesma força, formando uma molécula. Um átomo que contém o mesmo número de prótons e elétrons é eletricamente neutro, caso contrário é carregado positivamente ou negativamente e é chamado de íon. Um átomo é classificado de acordo com o número de prótons e nêutrons no seu núcleo: o número de prótons determina o elemento químico e o número de nêutrons determina o isótopo do elemento.Predefinição:Nota de rodapé O modelo atualmente aceito para explicar a estrutura atômica é o modelo da mecânica quântica.[17]
Antiátomos constituem a antimatéria, possuindo cargas elétricas inversas às dos átomos. São compostos por antipartículas denominadas pósitrons, antiprótons e antinêutrons.
Elemento químico é o termo coletivo para todos os tipos de átomos com o mesmo número atômico. Assim, todos os átomos de um elemento químico possuem necessariamente o mesmo número de prótons no núcleo. Um elemento é identificado por um símbolo, uma abreviatura que é na maioria dos casos derivada do nome em latim do elemento [por exemplo, Pb (plumbum), Fe (ferrum). Os elementos estão dispostos na tabela periódica em ordem crescente do número atômico. Um total de 118 elementos são conhecidos até esta data (2018).
Um composto químico é uma substância química pura composta por dois ou mais elementos químicos diferentes.Predefinição:HarvRefPredefinição:HarvRefPredefinição:HarvRef Os compostos químicos têm uma estrutura química única e definida e consistem em uma razão fixa de átomos, que são mantidos juntos num arranjo espacial definido por ligações químicas. Os átomos de um composto químico podem ser unidos por ligações covalentes, ligações iônicas, ligações metálicas ou por ligações covalentes coordenadas. Os elementos químicos não são considerados compostos químicos, mesmo que consistam em moléculas que contenham múltiplos átomos de um único elemento (como H2, S8, etc.), sendo estas chamadas moléculas diatômicas ou moléculas poliatômicas.Predefinição:HarvRef A nomenclatura de compostos químicos é uma parte crucial da linguagem química. No início da história, estes eram batizados com o nome de seu descobridor. No entanto hoje, a nomenclatura padrão é definida pela União Internacional de Química Pura e Aplicada (IUPAC). O sistema IUPAC de nomenclatura permite a distinção dos compostos por nomes específicos.
Uma substância química é um tipo de matéria com composição e conjunto de propriedades definidos.Predefinição:HarvRef Estritamente falando, uma mistura de compostos, elementos e compostos ou elementos não é uma substância química, mas pode ser chamado de produto químico. A maioria das substâncias que encontramos em nossa vida diária são misturas, como por exemplo o ar e a biomassa.

Uma molécula é uma entidade eletricamente neutra formada de dois ou mais átomos unidos por ligações covalentes.[18]Predefinição:HarvRefPredefinição:HarvRefPredefinição:HarvRefPredefinição:HarvRefPredefinição:HarvRef As moléculas são distinguidas dos íons pela ausência de carga elétrica. No entanto, em Física Quântica, Química Orgânica e Bioquímica, o termo molécula é usado frequentemente com menor rigor, sendo aplicado também aos íons poliatômicos. Na teoria cinética dos gases, o termo molécula é frequentemente utilizado para qualquer partícula gasosa, independentemente da sua composição. De acordo com essa definição, átomos de gases nobres são considerados moléculas, apesar do fato de que elas são compostas por um único átomo sem ligação química.Predefinição:HarvRef Uma molécula pode ser constituída por átomos de um único elemento químico, tal como com o oxigênio gasoso (O2), ou de diferentes elementos, como acontece com a água (H2O). Átomos e complexos ligados por ligações covalentes, como pontes de hidrogênio ou ligações iônicas geralmente não são considerados moléculas individuais.[19]
O íon (português brasileiro) ou ião (português europeu) é uma partícula eletricamente carregada, ou seja, é um átomo ou uma molécula que perdeu ou ganhou elétrons. Um íon é chamado cátion quando perde um ou mais elétrons, que são negativos, ficando carregado positivamente (por exemplo, o cátion sódio: Na+). Por outro lado, os ânions são os íons carregados negativamente, ou seja, ganharam eletróns (por exemplo, ânion cloreto: Cl−). Como exemplos de íons poliatômicas podem ser citados os íon hidróxido (OH−) ou o íon fosfato (PO43−). Os íons no estado gasoso são frequentemente chamados de plasma.
Conceitos envolvidos na transformação da matéria
Acidez e basicidade
Substâncias possuem propriedades ácidas e/ou básicas. Existem diferentes teorias que explicam o comportamento ácido-base. A mais simples é a teoria de Arrhenius, que diz que um ácido é uma substância que produz íons hidrônio, quando dissolvida em água; e uma base é uma substância que produz íons hidroxila, quando dissolvida em água. De acordo com a teoria ácido-base de Brønsted-Lowry, ácidos são substâncias que doam um cátion hidrogênio a outra substância em uma reação química; por extensão, uma base é a substância que recebe estes íons hidrogênio. A terceira teoria é teoria ácido-base de Lewis, o qual é baseado na formação de ligações químicas. A teoria de Lewis explica que um ácido é uma substância que é capaz de aceitar um par de elétrons de uma outra substância durante o processo de formação da ligação química, enquanto que a base é uma substância que cede um par de elétrons para formar uma nova ligação.[20] Existem várias outras maneiras em que uma substância pode ser classificada como um ácido ou de uma base, como é evidente na história deste conceito.[21]
A acidez pode ser mensurada especialmente por dois métodos. Uma delas, com base na definição de Arrhenius de acidez, é o potencial hidrogeniônico (pH). O pH é definido como o logarítmo decimal do inverso da atividade de íons hidrogênio, aH+, em uma solução.[22] Assim, as soluções que têm um baixo pH tem alta concentração de íons hidrônio, e pode-se dizer que são mais ácidas.
Outra maneira, que tem como base a definição de Bronsted-Lowry, é a constante de dissociação de um ácido (Ka), que medem a capacidade relativa de uma substância para agir como um ácido sob a definição de Bronsted-Lowry. Isto é, as substâncias com um Ka maior são mais propensas a doar íons hidrogênio em reações químicas do que aquelas com menores valores de Ka.
Fase

Em ciências físicas, fase é uma região do espaço (um sistema termodinâmico), no qual todas as propriedades físicas são essencialmente uniformes.Predefinição:HarvRef Exemplos de propriedades físicas incluem a densidade, índice de refração, magnetização e composição química. Uma descrição mais simples é que uma fase é uma região de um material que é quimicamente uniforme, fisicamente distinta e (frequentemente) mecanicamente separáveis. Num sistema composto por gelo e água num frasco de vidro, os cubos de gelo são uma fase, a água é uma segunda fase e o ar úmido sobre a água é uma terceira fase.
A termo fase é usado às vezes como sinônimo de estado da matéria. Além disso, por vezes é utilizado para se referir a um conjunto de estados de equilíbrio demarcados em termos de variáveis de estado, tais como pressão e temperatura por um limite de fase em um diagrama de fases. Como os limites de fase se relacionam às alterações na organização da matéria, tais como a mudança do estado líquido para o estado sólido ou de uma alteração mais sutil de uma estrutura de cristal para o outro, este último uso é semelhante à utilização de fase como sinônimo de estado da matéria. No entanto, o uso dos termos estado da matéria e diagrama de fase não são compatíveis com a definição formal citada acima e o significado pretendido deve ser determinado a partir do contexto em que o termo é utilizado. Diferentes tipos de estados ou fases são considerados com o sólido, líquido e gasoso, o condensado de Bose-Einstein e o plasma, sendo que estes dois últimos são estudados em níveis avançados da física.
Ligação
Uma ligação química ocorre quando uma interação entre os átomos permite a formação de substâncias químicas que contêm dois ou mais átomos. A ligação é provocada por força de atração eletrostática entre as cargas opostas, quer entre elétrons e os núcleos, ou como o resultado de uma atração dipolar. A força das ligações químicas varia consideravelmente em termos energéticos; existem "ligações fortes", como as ligações covalentes ou iônicas e "ligações fracas", tais como interações dipolo-dipolo, a força dispersão de London e ligações de hidrogênio. A muitos compostos, a teoria da ligação de valência, o modelo de repulsão dos pares eletrônicos (VSEPR) e o conceito do número de oxidação são usados para explicar a estrutura molecular e formação das ligações químicas. Outras teorias de ligação, como a teoria do orbital molecular também são muito utilizadas.
Reação
Arquivo:Iodine clock - persulphate.ogv
Uma reação química é um processo que leva a transformação de uma substâncias a outra.[23] Classicamente, as reações químicas compreendem alterações que envolvem o movimento dos elétrons na formação e quebra de ligações químicas entre os átomos. A substância (ou substâncias) inicialmente envolvida numa reação química é chamada de reagente. As reações químicas produzem um ou mais produtos, que em geral têm propriedades diferentes das dos reagentes. Reações muitas vezes consistem de uma sequência de subetapas e as descrição exata sobre o curso destas reações ilustram um mecanismo de reação. As reações químicas são descritas com equações químicas que apresentam graficamente os materiais de partida, os produtos finais e os intermediários, por vezes, as condições de reação.
Reações químicas acontecem a uma taxa reacional característica a uma dada concentração e temperatura. Reações que ocorrem rapidamente são descritas como espontâneas, que não exigem o fornecimento de energia extra. As reações não espontâneas ocorrem tão lentamente que exigem a introdução de algum tipo de energia adicional (tal como o calor, luz ou de eletricidade), a fim de se completar ou atingir o equilíbrio químico.
Diferentes reações químicas são combinadas durante a síntese química, de modo a obter um produto desejado. Em bioquímica, uma série de reações químicas formam as vias metabólicas. Essas reações são geralmente mediadas por enzimas. Essas enzimas catalisam muitas reações que não ocorreriam sob condições presentes no interior de uma célula.
O conceito geral de reação química foi estendido para entidades menores do que os átomos, incluindo as reações nucleares, decaimentos radioativos e reações entre partículas elementares, como descrito pela teoria quântica de campos.
Mol
O mol é o nome da unidade de base do Sistema Internacional de Unidades (SI) para a grandeza quantidade de matéria.[24][25] É uma das sete unidades de base do Sistema Internacional de Unidades.Predefinição:HarvRef O seu uso é comum para simplificar representações de proporções químicas e no cálculo de concentração de substâncias. O Escritório Internacional de Pesos e Medidas define: "Um mol contém exatamente 6,022 140 76 x 1023 entidades elementares".[26]
Redox
Reações redox (redução-oxidação) incluem todas as reações químicas em que átomos têm o seu estado de oxidação alterado por transferência de elétrons, seja pelo ganho (redução) ou perda de elétrons (oxidação). As substâncias que possuem a capacidade de oxidar outras substâncias são chamadas de oxidantes (agentes oxidantes). Do mesmo modo, as substâncias que tem a capacidade de reduzir outras substâncias são ditas redutoras e são conhecidos como agentes redutores. Um redutor transfere elétrons a outra substância, então ele sofre oxidação. A oxidação e redução refletem a alteração no número de oxidação - a transferência efectiva de electrões nunca pode ocorrer. Assim, a oxidação é melhor definida como um aumento no número de oxidação, de redução e como uma diminuição no número de oxidação.
Equilíbrio
Em uma reação química, o equilíbrio químico é o estado em que ambos os reagentes e produtos estão presentes em concentrações e estas não tendem a se alterar com o tempo.Predefinição:HarvRef Geralmente, este estado resulta quando a reação (produtos para reagentes) prossegue à mesma taxa que a reação inversa (produtos para reagentes). As taxas reacionais de ambas não são iguais a zero, mas sendo iguais, não existem alterações líquidas das concentrações tanto dos reagentes quanto dos produtos. Esse processo é chamado de equilíbrio dinâmico.Predefinição:HarvRef[27]
Energia
No contexto de Química, a energia é um atributo de uma substância como uma consequência da agregação de sua estrutura atômica ou molecular. Uma vez que uma transformação química gera mudanças na estrutura de uma substância, o processo é invariavelmente acompanhado por um aumento ou diminuição de energia nas substâncias envolvidas. Parte da energia é transferida entre o ambiente e os reagentes sob a forma de calor ou de luz; assim, os produtos de uma reação podem ser mais ou menos energéticos do que os reagentes.
A reação é dita ser exergônica a variação da energia livre de Gibbs tem valor negativo, indicando a possibilidade de uma reação espontânea. No caso de endergônicas a situação é inversa. A reação é dito ser exotérmica se liberta calor para o ambiente e as reações exotérmicas absorvem o calor do meio.
As reações químicas são invariavelmente impossível, a menos que os reagentes superem uma barreira de energia conhecida como energia de ativação. A velocidade de uma reação química (em dada temperatura T) está relacionada com a energia de ativação E pelo Fator de Boltzmann, - que expressa a possibilidade de uma molécula ter uma energia maior ou igual a E em dada temperatura T. Esta dependência exponencial da taxa de reação em dada temperatura é conhecida como equação de Arrhenius. A energia de ativação necessária para que uma reação química ocorra pode ser na forma de calor, luz, eletricidade ou força mecânica sob a forma de ultra-som.[28]
O conceito de energia livre, que também incorpora considerações sobre entropia, é um meio muito útil para prever a possibilidade de ocorrência de uma reação química e determinar o estado de equilíbrio de uma reação em termodinâmica química. A reacção só é possível se a mudança total na energia livre de Gibbs negativa, , e, se for igual a zero, a reação química está em equilíbrio.
Existem apenas limitados possíveis estados de energia para elétrons, átomos e moléculas. Estas são determinadas pelas regras da mecânica quântica, que exigem quantização da energia. Os átomos e moléculas em um estado energético estão em estado excitado. Moléculas e átomos que substância neste estado energético são frequentemente muito mais reativos, isto é, mais passíveis de reações químicas.
A fase de uma substância é determinada pela sua energia própria e a energia do ambiente. Quando as forças intermoleculares de uma substância é tal que a energia do ambiente não é suficiente para superá-las, ocorrem então as fases mais ordenada, como líquido e sólido, como é o caso com a água (H2O), um líquido à temperatura ambiente porque as suas moléculas interagem por ligações de hidrogênio.[29] O sulfeto de hidrogênio (H2S) é um gás a temperatura e pressão padrão porque as suas moléculas interagem por interações dipolo-dipolo, que são mais fracas.
A transferência de energia a partir de uma substância química para outra depende do tamanho dos quanta de energia emitidos a partir de uma substância. No entanto, a energia térmica é frequentemente transferida mais facilmente de qualquer substância para outra porque os fônons responsáveis pelos níveis de energia vibracional e rotacional em uma substância têm muito menos energia do que os fótons invocados para a transferência de energia eletrônica. Assim, devido aos níveis de energia vibracional e rotacional serem mais próximos espacialmente mais espaçados do que os níveis eletrônicos de energia, o calor é mais facilmente transferido entre substâncias em relação à luz ou de outras formas de energia eletrônica. Por exemplo, a radiação eletromagnética ultravioleta não é transferida com o máximo de eficiência de uma substância a outra como a energia térmica ou elétrica.
A existência de níveis de energia característicos para as diferentes substâncias químicas é útil para a sua identificação por meio da análise de linhas espectrais. Diferentes tipos de espectros são frequentemente utilizados em espectroscopia, por exemplo, o infravermelho e microondas. A espectroscopia também é utilizada para identificar a composição de objetos remotos - como estrelas e galáxias distantes - analisando os seus espectros de radiação.
Química Inorgânica

Química Inorgânica é o campo da química que estuda a estrutura, reatividade e preparação dos compostos inorgânicos e organometálicos. Este domínio abrange todos os compostos químicos, com exceção dos compostos orgânicos, que são temas de estudo da Química Orgânica. A distinção entre as duas disciplinas está longe de ser absoluta e há muita sobreposição, especialmente na disciplina Química Organometálica. A Química Inorgânica tem aplicações em todos os aspectos da indústria química, incluindo catálise, ciência dos materiais, pigmentos, surfactantes, revestimentos, medicamentos, combustíveis e agricultura.[30]
Classificação dos compostos inorgânicos

Os compostos inorgânicos são classificados em quatro grandes grupos: os sais, os óxidos, os ácidos e as bases. Os sais são constituídos de um cátion e um ânion unidos por uma ligação iônica, como por exemplo o brometo de sódio NaBr, que é constituído de um cátion Na+ e um ânion de brometo Br−. Os sais são caracterizados por um alto ponto de fusão e são maus condutores de eletricidade no estado sólido. Outras características importantes são a solubilidade em água e a facilidade de cristalização. Alguns sais (por exemplo NaCl) são muito solúveis em água e outros (por exemplo BaSO4) não o são.
Um óxido é um composto químico que contém pelo menos um átomo de oxigênio e um outro elemento químico em sua fórmula química. Óxidos de metais contêm tipicamente um ânion de oxigênio no estado de oxidação de -2. A maior parte da crosta terrestre é constituída de óxidos sólidos, resultado de elementos que são oxidados pelo oxigênio no ar ou dissolvido na água. A combustão de hidrocarbonetos produz os dois principais óxidos de carbono: monóxido de carbono e dióxido de carbono.
A teoria de Brønsted-Lowry define como bases como aceitadores de íons de hidrogênio, enquanto a teoria de Lewis define bases como doadores de par de elétrons. A teoria mais antiga é a de Arrhenius, que define bases como espécies que liberam ânion hidróxido quando em solução e é estritamente aplicável aos compostos alcalinos.
A definição para ácidos segue o raciocínio contrário da definição de base. A teoria de Brønsted-Lowry define como ácidos substâncias que doam íons hidrogênio, enquanto a teoria mais geral de Lewis define ácidos como aceitadores de par de elétrons. A teoria de Arrhenius define como ácidos espécies que liberam íons hidrogênio em solução aquosa.
Química de Coordenação

Os compostos de coordenação tradicionais apresentam metais ligados a pares de elétrons que se encontram nos átomos dos grupos ligantes, tais como H2O, NH3, Cl− e CN−. Em compostos de coordenação modernos quase todos os compostos orgânicos e inorgânicos podem ser utilizados como ligantes. O metal é geralmente um metal dos grupos 3-13, assim como os trans-lantanídeos e trans-actinídeos. A estereoquímica dos complexos de coordenação pode ser muito rica, como sugerido por Alfred Werner após a separação de dois enantiômeros de [Co((OH)2Co(NH3)4)3]6+, uma manifestação precoce de que a quiralidade não é inerente aos compostos orgânicos. Um tema dentro deste tópico é a química supramolecular de coordenação.Predefinição:HarvRef
Exemplos de compostos de coordenação: [Co(EDTA)]−, [Co(NH3)6]3+, TiCl4(THF)2.
Os principais elementos da tabela periódica estão nos grupos da 1, 2 e 13-18 (excluindo o hidrogênio), mas devido à sua reatividade, os elementos do grupo 3 (Sc, Y, La) e do grupo 12 (Zn, Cd e Hg) são também geralmente incluídos entre os principais.
Principais compostos de grupo
Compostos do grupo principal são conhecidos desde os primórdios da química como o enxofre elementar e o fósforo branco. Experimentos com oxigênio, O2, realizados por Lavoisier e Priestley não só identificou um gás diatômico importante, mas abriu o caminho para descrever compostos e reações de acordo com razões estequiométricas. A descoberta de uma síntese da amônia bastante prática usando catalisadores de ferro por Carl Bosch e Fritz Haber no início de 1900 impactou a humanidade profundamente, demonstrando a importância da síntese inorgânica. Típicos compostos do grupo principal são SiO2, SnCl4, e N2O. Muitos compostos do grupo principal pode também ser classificados como "organometálicos", uma vez que contêm grupos orgânicos, por exemplo, B(CH3)3). Os compostos do grupo principal também ocorrem na natureza, por exemplo, fosfato de DNA e, portanto, podem ser classificados como bioinorgânicos. Por outro lado, os compostos orgânicos que não estão ligados a hidrogênio são classificados como compostos inorgânicos, tais como os fulerenos e os óxidos de carbono.
Os compostos que contêm metais do grupo 4 a 11 são considerados compostos de metais de transição. Alguns compostos de um metal do grupo 3 ou 12 são, por vezes, também incorporadas neste grupo, mas também muitas vezes classificados como compostos do grupo principal. Compostos de metais de transição mostram uma química de coordenação rica, variando de tetraedros de titânio (por exemplo, TiCl4) à geometria quadrado planar de alguns complexos de níquel e complexos de coordenação octaédrica para compostos de cobalto. Uma gama de metais de transição podem ser encontrados em compostos biologicamente importantes, tais como o ferro na hemoglobina.
Exemplos de composto contendo metais de transição: pentacarbonilo de ferro e cisplatina.
Química Analítica
Química Analítica é um ramo da Química que visa estudar a composição química de um material ou de uma amostra, usando métodos laboratoriais. É dividida em Química Analítica Quantitativa e Química Analítica Qualitativa. A busca por métodos de análise mais rápidos, seletivos e sensíveis também é um dos objetivos essenciais da Química Analítica. Na prática, é difícil encontrar um método de análise que combinem essas três características e, em geral, qualquer uma delas pode ser suprimida em benefício de outra.
Química Analítica Quantitativa

Em Química, análise quantitativa é a determinação da abundância relativa ou absoluta (muitas vezes expressa como uma concentração) de uma, várias ou todas as substâncias presentes em uma amostra. Vários métodos foram desenvolvidos para este tipo de análise, dentre elas a análise gravimétrica e a análise volumétrica. A análise gravimétrica descreve um conjunto de métodos para a determinação da quantidade de um analito com base na massa sólida. Um exemplo simples é a determinação da quantidade de sólidos em suspensão em uma amostra de água: um volume conhecido de água é filtrado e os sólidos recolhidos no filtro são então pesados.[31][32] A análise gravimétrica fornece dados precisos sobre a composição de uma amostra e seu tempo de execução pode ser elevado. Já a análise volumétrica, por outro lado, é rápida e os resultados são na maioria dos casos satisfatórios: essas análises consistem basicamente em processos de titulação, também conhecido como titulometria, onde são monitorados os volumes usados nestas etapas. Um reagente, chamado o titulante é preparado como uma solução padrão. Uma concentração conhecida e volume de titulante reage com uma solução de analito ou de titulante, para determinar a concentração. Análise volumétrica pode ser simplesmente uma titulação com base numa reação de neutralização, mas também pode ser uma precipitação ou uma reação de formação de um complexo, bem como a titulação com base em uma reação redox. No entanto, cada método de análise quantitativa tem uma especificação geral, em neutralização, por exemplo, a reação que ocorre é entre um ácido e uma base, a qual produz um sal e água, daí o nome de neutralização. Nas reações de precipitação, a solução padrão é na maioria dos casos de nitrato de prata, que é usada para reagir com os íons presentes na amostra no intuito de formar um precipitado insolúvel. Métodos de precipitação são muitas vezes chamado simplesmente de argentometria. Nos dois outros métodos, a situação é a mesma. A titulação de formação de um complexo é uma reação que ocorre entre os íons de um metal e uma solução padrão que contem na maioria dos casos, o EDTA (ácido etilenodiaminotetra-acético). Em uma titulação redox, a reação é ocorre entre um agente oxidante e um agente redutor.
Química Analítica Qualitativa
Enquanto a análise quantitativa se preocupa em determinar a quantidade de determinada(s) substância(s) em uma amostra, a análise qualitativa usa diversas metodologias clássicas que visam especificar a composição elementar de compostos inorgânicos. É focada principalmente em detectar íons em uma solução aquosa: então para que materiais sólidos sejam analisados, estes devem preferencialmente serem convertidos em soluções, geralmente por um processo denominado digestão. A solução é então tratada com diversos reagentes para testar a reações características de determinados íons, que podem causar mudança da cor da solução em análise, formação de precipitado ou outras mudanças visíveis.[33] De acordo com as suas propriedades, os cátions são classificados em seis grupos. Cada grupo possui um reagente de comum que pode ser utilizado para separá-los a partir da solução. Para se obter resultados significativos, a separação segue uma sequência específica chamada marcha analítica. Outra importante técnica usada para identificar cátions metálicos é o teste da chama: esse procedimento se baseia no espectro de emissão característico para cada elemento, quando em contato com chama. O teste envolve a introdução da amostra em chama e a observação da cor resultante. As amostras geralmente são manuseadas com um fio de platina previamente limpo com ácido clorídrico para retirar resíduos de analitos anteriores. O teste de chama é baseado no fato de que quando uma certa quantidade de energia é fornecida a um determinado elemento químico (no caso da chama, energia em forma de calor), alguns elétrons da última camada de valência absorvem esta energia passando para um nível de energia mais elevado, produzindo o que chamamos de estado excitado. Quando um desses elétrons excitados retorna ao estado fundamental, ele libera a energia recebida anteriormente em forma de radiação. Cada elemento libera a radiação em um comprimento de onda característico, pois a quantidade de energia necessária para excitar um elétron é única para cada elemento. A radiação liberada por alguns elementos possui comprimento de onda na faixa do espectro visível, ou seja, o olho humano é capaz de enxergá-los através de cores. Assim, é possível identificar a presença de certos elementos devido à cor característica que eles emitem quando aquecidos numa chama.
Físico-Química
Físico-Química é o estudo das propriedades físicas e químicas da matéria, incluindo fenômenos macroscópicos, atômicos e subatômicos, sob a ótica das leis e conceitos da física. A Físico-Química aplica os princípios, práticas e conceitos da física como movimento, energia, força, tempo, termodinâmica, mecânica quântica, mecânica estatística e dinâmica para explicar fenômenos químicos.
Disciplinas da Físico-Química
A Físico-Química pode ser subdividida em diversas disciplinas. Dentre estas, podem ser citadas a Química Quântica (estuda e estrutura da matéria em escala atômico-molecular e a interação da luz eletromagnética com a matéria), a Termodinâmica Química (estuda em escala macroscópica o ganho e perda de energia em transformações da matéria, bem como a relação com espontaneidade de processos e equilíbrio de sistemas), a Cinética Química (estuda a velocidade de processos, físicos ou químicos), e a Mecânica Estatística (estuda a relação entre quantização de energia e propriedades macroscópicas de sistemas e processos através de distribuição estatística). Subdisciplinas como Eletroquímica, Química de Superfícies, Termoquímica, e Química de Sistemas Coloidais podem ser enquadradas dentro da Termodinâmica, enquanto a Espectroscopia dentro da Química Quântica.

A Química Quântica é um ramo da Físico-Química cujo foco principal é a aplicação dos conceitos da mecânica quântica a modelos físicos e experimentais de sistemas químicos. Uma das ferramentas mais usadas nestes estudos é a espectroscopia, por meio do qual a informação sobre a quantização de energia em escala molecular pode ser obtida. Os métodos espectroscópicos mais comuns são a espectroscopia de infravermelho (IV) e de ressonância magnética nuclear (RMN). Os estudos em Química Quântica são bastante teóricos e os trabalhos possuem grande interface com a Química Computacional, visando a calcular as previsões da teoria quântica às espécies poliatômicas. Esses cálculos são realizados em computadores. Com estes meios, os químicos quânticos investigam aspectos envolvidos em reações química como o estado fundamental e excitado de átomos em moléculas e o estado de transição que ocorre durante as reações químicas. Os objetivos principais de Química Quântica incluem o aumento da exatidão dos resultados para pequenos sistemas moleculares e o processamento de moléculas de maiores dimensões, o qual é limitado por um motivo: o tempo de cálculo aumenta quanto maior for o número de átomos de uma molécula.
Outro conjunto de questões importantes giram em torno da espontaneidade das reações químicas e e quais as propriedades de uma mistura de compostos químicos. Esses aspectos são estudados pela Termodinâmica Química, que prevê a possibilidade de uma reação prosseguir, a quantidade de energia que pode ser convertida em trabalho e o estudo de propriedades tais como o coeficiente de dilatação térmica, a variação de taxa de entropia de um gás ou de um líquido.Predefinição:HarvRef A Termodinâmica clássica está mais preocupada com os sistemas em equilíbrio e as mudanças reversíveis.
A ideia fundamental da Cinética Química é a existência de um estado de transição de energia elevada quando reagentes são convertidos em produtos, ou seja uma barreira energética.Predefinição:HarvRef De um modo geral, quanto maior for esta barreira energética, mais lenta será a reação. A segunda ideia fundamental é de que a maioria das reações químicas ocorrem como uma sequência de reações elementares,Predefinição:HarvRef cada uma com seu próprio estado transição. As questões principais da cinética química incluem como a velocidade de uma reação depende da temperatura e das concentrações dos reagentes e de catalisadores na mistura reacional, bem como a forma como os catalisadores e condições de reação podem ser manipuladas para otimizar a taxa de reação.

A medida de quão rápida uma reação pode ocorrer pode ser especificada com apenas poucas amostragens da concentrações e pelo monitoramento da temperatura, ao invés de medir todas as posições e velocidades de cada molécula em uma mistura. Esse é um caso especial de um outro conceito fundamental em Físico-Química: a Mecânica Estatística.Predefinição:HarvRef A Mecânica Estatística estuda o comportamento de sistemas com elevado número de entidades constituintes a partir do comportamento destas entidades. Os constituintes podem ser átomos, moléculas, íons, entre outros.
A Eletroquímica é um ramo da Termodinâmica Química que estuda reações químicas que ocorrem em uma solução envolvendo um eletrodo (um metal ou um semicondutor) e um condutor iônico (em geral uma solução eletrolítica), envolvendo trocas de elétrons entre o eletrodo e o eletrólito. Esse campo científico abrange todos os processos químicos que envolvam transferência de elétrons entre substâncias, logo, a transformação de energia química em energia elétrica. Quando tal processo ocorre, produzindo transferência de elétrons, produzindo espontaneamente corrente elétrica quando ligado a um circuito elétrico, ou produzindo diferença de potencial entre dois pólos, é chamado de pilha ou bateria (que muitas vezes é formada de diversas células). Quando tal processo é proporcionado, induzido, pela ação de uma corrente elétrica de uma fonte externa, este processo é denominado de eletrólise.
Química Orgânica
A Química Orgânica é uma especialidade dentro da química que envolve o estudo científico da estrutura, propriedades, composição, reações e preparação (por síntese ou por outros meios) de compostos contendo carbono e seus derivados. Estes compostos podem conter átomos outros elementos, incluindo o hidrogênio, nitrogênio, oxigênio, além de halogênios, fósforo, silício e enxofre.Predefinição:HarvRefPredefinição:HarvRef[34] Compostos orgânicos formam a base de toda a vida terrena e são estruturalmente bastante diversificados. A gama de aplicação de compostos orgânicos é enorme, sendo os principais componentes de muitos produtos, como plásticos, medicamentos, produtos petroquímicos, alimentos, materiais explosivos e tintas.
Cromatografia e identificação estrutural

Os compostos orgânicos naturais ou mesmo produtos sintéticos estão muitas vezes em misturas e uma variedade de técnicas foram desenvolvidas para avaliar a pureza e separar uma substância da outra. As técnicas mais modernas para separação e análise de amostras orgânicas são a cromatografia líquida de alta eficiência e cromatografia gasosa. Os métodos tradicionais de separação incluem a cristalização, destilação, extração com solvente e por cromatografia em coluna. A espectroscopia de ressonância magnética nuclear (RMN) é a técnica mais habitualmente utilizada para a determinação da estrutura de compostos orgânicos e permite a atribuição completa da conectividade dos átomos e mesmo a estereoquímica. Outros métodos bastante usados para a análise de compostos orgânico são a espectrometria de massa e a cristalografia. Técnicas como a análise elementar,a espectroscopia de infravermelho, rotação óptica e a espectroscopia UV/visível fornecem dados complementares, não sendo usadas isoladamente para determinação estrutural.
Propriedades físicas
As propriedades físicas dos compostos orgânicos incluem tanto aspectos quantitativos quanto qualitativos. Informação quantitativas incluem o ponto de fusão, ponto de ebulição e índice de refração. As propriedades qualitativas incluem odor, solubilidade, consistência e cor. Os compostos orgânicos, quando comparados aos inorgânicos, possuem baixo ponto de fusão e ebulição, sendo estes valores correlacionados diretamente à polaridade das moléculas e ao seu peso molecular. Alguns compostos orgânicos, especialmente os simétricos, sublimam, isto é eles evaporam sem passar pelo estágio de fusão. Um exemplo bem conhecido de um composto orgânico sublimável é para-diclorobenzeno. Compostos orgânicos não são geralmente muito estáveis a temperaturas acima de 300 °C, apesar de algumas exceções existirem. Os compostos orgânicos tendem a ser hidrofóbicos, isso é, elas são menos solúveis em água do que em solventes orgânicos. As exceções incluem compostos orgânicos que contêm grupos ionizáveis, bem como álcoois de baixo peso molecular, aminas e ácidos carboxílicos em que ocorrem a ligação de hidrogênio.
Nomenclatura e estrutura
A nomenclatura destes compostos seguem a sistemática estipulada pelas especificações da IUPAC. Para utilizar a nomenclatura sistemática, deve-se reconhecer a estrutura principal e os substituintes. Nomes não sistemáticos são comuns para moléculas complexas, especialmente para produtos naturais. Assim, a dietilamida do ácido lisérgico ou LSD, desta modo informalmente chamado, é sistematicamente denominado (6aR,9R)-N,N-dietil-7-metil-4,6,6a,7,8,9-hexahidroindolo-[4,3-fg]-quinolina-9-carboxamida. As moléculas orgânicas são descritas por fórmulas estruturais, combinações de desenhos e símbolos químicos. A fórmula de linha é bastante utilizada para representar as molecular orgânicas por ser simples e não ambígua. Neste sistema, os pontos de extremidade e os cruzamentos de cada linha representa um átomo de carbono e os átomos de hidrogênio podem ser notados ou explicitamente assumida para estar presente como implícito no carbono tetravalente.
O conceito de grupos funcionais é central na química orgânica, tanto como um meio para classificar estruturas e como para a previsão de suas propriedades físico-químicas. Um grupo funcional é um módulo molecular, e a reatividade de um determinado grupo funcional, dentro de certos limites, é semelhante em diferentes moléculas. As moléculas são classificadas com base em seus grupos funcionais. Álcoois, por exemplo, possuem sempre a subunidade C-OH. Os hidrocarbonetos alifáticos são subdivididos em três grupos de séries homólogas de acordo com seu estado de saturação: parafinas ou alcanos, não possuem quaisquer ligações duplas ou triplas; olefinas ou alcenos, contêm uma ou mais ligações duplas e os alcinos têm uma ou mais ligações triplas. As outras moléculas são classificadas de acordo com os grupos funcionais presentes: álcool, ácido carboxílico, éter, éster, aminas, amida entre outros. Compostos saturados e insaturados existem também como estruturas cíclicas. Os anéis mais estáveis contêm cinco ou seis átomos de carbono. Outra importante classe de compostos orgânicos são os aromáticos: o benzeno é a substância mais conhecida, simples e estável. Estes hidrocarbonetos aromáticos contém diversas ligações duplas conjugadas e que obedecem ao modelo postulado por Kekulé. Outra importante propriedade do carbono é que formam cadeias, ou redes, que são ligados por ligações carbono-carbono. Esse processo de ligação é chamado de polimerização, ao passo que as cadeias ou redes, são chamadas polímeros. O composto de origem é chamado um monómero. Dois grupos principais de polímeros existem: polímeros sintéticos e biopolímeros. Os polímeros sintéticos são artificialmente produzido e são comumente referidos como polímeros industriais.[35]
Reações em Química Orgânica
Reações orgânicas são reações químicas envolvendo compostos orgânicos. A teoria geral dessas reações envolve conceitos de afinidade eletrônica do átomo-chave, impedimento estérico, ácido-base e intermediários reativos. Os tipos de reação básicos são: reações de adição, reações de eliminação, reações de substituição, reações pericíclicas, reações de rearranjo e reações redox. Cada reação possui um mecanismo de reação passo a passo que explica como acontece a sequência reacional, embora a descrição detalhada de alguns passos nem sempre é clara a partir de uma lista de reagentes isolados. O curso passo a passo de qualquer mecanismo de reação pode ser representado usando setas curvas, que indicam a movimentação de elétrons entre os reagentes, intermediários e produtos finais.
A Química Orgânica aplicada é chamada de Química Orgânica sintética. A síntese de um novo composto é normalmente uma tarefa de resolução de problemas. Os compostos são sintetizados seguindo uma rota sintética, onde a molécula ganha forma depois de várias etapas de conexão de moléculas menores. A prática de criar novas vias sintéticas para moléculas complexas é chamada de síntese total. Devido a complexidade e a utilização de reagente muitas vezes caros, é necessário um adequado planeamento de cada etapa reacional, sempre visando o máximo rendimento possível.
Bioquímica
Bioquímica é a ciência que estuda os processos químicos que ocorrem nos organismos vivos. De maneira geral, ela consiste do estudo da estrutura e função metabólica de componentes celulares e virais, como proteínas, enzimas, carboidratos, lipídios, ácidos nucléicos entre outros.[36][37]Predefinição:HarvRef
Bioquímica Estrutural

|

|
Esse ramo da Bioquímica preocupa-se em estudar os aspectos estruturais das biomoléculas. As quatro principais classes de biomoléculas são os carboidratos, os lípidos, as proteínas e os ácidos nucleicos. Muitas moléculas biológicas são polímeros: neste terminologia, os monômeros são micromoléculas relativamente pequenas que estão ligadas em conjunto para gerar estas grandes macromoléculas. Diferentes macromoléculas podem reunir-se em complexos maiores, muitas vezes necessários para a atividade biológica. Os carboidratos, por exemplo, são constituídos de diversos monômeros chamados monossacarídeos. Alguns destes monossacáridos incluem a glicose (C6H12O6), a frutose (C6H12O6) e a desoxirribose (C5H10O4). Os lipídeos são biossintetizados a partir de uma molécula de glicerol combinado com outras moléculas. Os triglicerídeos, a principal classe de lipídeos, são constituídos por uma molécula de glicerol e três moléculas de ácidos graxos. Os ácidos graxos, também considerados monômeros, podem ser saturados ou insaturados. As proteínas são biomoléculas muito grandes - macro-biopolímeros - sintetizadas a partir de monômeros chamados aminoácidos. Existem 20 aminoácidos essenciais, cada um contendo um grupo carboxilo, um grupo amino e uma cadeia lateral, chamada de grupo "R". O grupo "R" varia entre os aminoácidos, o que faz com que cada um destes aminoácido seja diferente um do outro. Estas diferenças e as propriedades destas cadeias laterais influenciam imensamente a conformação tridimensional de uma proteína. Quando os aminoácidos se combinam, formam uma ligação especial chamada ligação peptídica. Estas são reações de desidratação e os produtos podem ser um peptídeo ou uma proteína. Por fim, os ácidos nucleicos são as biomoléculas envolvidas no armazenamento, transferência e tradução da informação genética: o DNA e os RNAs. Estes ácidos nucleicos possuem elevada massa molecular, e contêm em sua estrutura molecular ácido fosfórico, pentoses (monossacarídeo) e bases purínicas e pirimidínicas. São portanto macromoléculas formadas por nucleotídeos.[38] Os nucleotideos são a adenina, citosina, guanina, timina e uracila, sendo que timina é presente somente no DNA e a uracila somente no RNA. A adenina liga-se com a timina e a uracila; a guanina e citosina pode ligar apenas uma com a outra.
Bioquímica Metabólica
A Bioquímica Metabólica estuda os processos de anabolismo e catabolismo de biomoléculas, as vias metabólicas e os processos energéticos envolvidos nestas reações químicas. Os carboidratos têm como uma de suas funções o armazenamento de energia. A glicose, dentre as biomoléculas, possui papel central como fonte de energia para a maioria das formas de vida. Os polissacarídeos de reserva são decompostos em seus monómeros: em animais, o glicogênio é degradado enzimaticamente em resíduos de glicose). A glicose é metabolizada principalmente por uma via muito importante de 10 etapas chamada glicólise ou via glicolítica. O resultado líquido desta sequencia de reações para quebrar uma molécula de glicose em duas moléculas de piruvato, é a produção de duas moléculas de ATP (adenosina trifosfato), a fonte de energia das células, juntamente com dois equivalentes reduzidos sob a forma de NADH. Energia também pode ser obtida por meio de processos anaeróbicos, quando as células não contam com a presença de oxigênio suficiente. Estes processos são denominados fermentação. Outras vias importantes são as de biossíntese e degradação de lipídeos. A síntese de ácidos graxos envolve moléculas de acetil-CoA e subsequentemente a esterificação para a produção de triglicerídeos, em um processo chamado de lipogênese.[39] Os ácidos graxos são sintetizados pela ação da enzima ácido graxo sintase, que polimerizam e reduzem as unidades acetil-CoA. As cadeias acílicas são estendidos por um ciclo de reações que adicionam o grupo acetila, reduzem-na a um álcool e desidratam-lo a um grupo alceno e depois reduzi-la novamente a um grupo alcano. Os ácidos graxos podem ser subsequentemente convertidos em triglicerídeos, que serão armazenados no fígado e no tecido adiposo. Já a degradação de lipídeos é realizada pelo processo de betaoxidação e ocorre nas mitocôndrias e/ou em peroxissomos para gerar acetil-CoA. Para a maior parte, os ácidos graxos são oxidados por um mecanismo que é similar, mas não idêntico, a reação inversa de síntese de ácidos graxos. Ou seja, dois fragmentos de carbono são removidos sequencialmente da extremidade do ácido, após as etapas de desidrogenação, hidratação e oxidação, para formar um cetoácido, que será então fragmentado em uma reação de tiólise. A acetil-CoA é então convertido em ATP, em última análise, CO2, H2O, utilizando o ciclo do ácido cítrico e a cadeia transportadora de elétrons. É interessante notar que por este fato, o Ciclo de Krebs pode começar em acetil-CoA, quando a gordura está sendo usado como fonte de energia quando há pouca ou nenhuma disponível. O rendimento energético da oxidação completa de uma molécula de ácido palmítico, por exemplo, é de 106 moléculas de ATP.[40] Ácidos graxos insaturados e com número ímpar de átomos de carbono requerem passos adicionais para a degradação enzimática.

Sonoquímica
Sonoquímica é o ramo da química que estuda o uso de ondas sonoras de alta frequência (ultrassons) para a promoção de reações químicas.[41] A cavitação acústica gerada por métodos sonoquímicos[42] possibilita a produção de compostos como TiO2 (dióxido de titânio),[43] H2O2 (peróxido de hidrogênio), radicais livres e outros.[41]
Química e sociedade

A aplicação da Química aos processos industriais e o desenvolvimento de novos produtos trouxe, sem dúvida, inestimáveis benefícios a toda a humanidade. O descobrimento de medicamentos - como exemplo a penicilina[44] e o taxol - provenientes de fontes naturais e a possibilidade de obter substâncias sintéticas em laboratório - como a dipirona e o omeprazol - proporcionou alívio e a cura de diversas doenças. Consequentemente, a expectativa de vida população aumentou. Além de medicamentos, a pesquisa na área química gerou o desenvolvimento de novos combustíveis, materiais como o polietileno e o náilon, produtos cosméticos e de higiene pessoal, alimentos, petroquímicos, tintas e vernizes entre outros[45][46]
Acompanhando o desenvolvimento dos processos químicos industriais, problemas gerados pelo descarte inadequando de substâncias e produtos químicos acarretaram novos problemas, como a poluição ambiental. Diante dessas consequências indesejáveis, coube aos profissionais químicos não somente o desenvolvimento novos produtos e processos químicos eficientes, mas planejar que estes não fossem poluentes, evitando os danos causados por algumas substâncias químicas. Propostas e ações de remediação ambiental, visando a correção de áreas afetadas bem como o aproveitamento racional dos recursos naturais são preocupações inerentes a estes profissionais. A profissão de químico é regulamentada e a ele são atribuídos o magistério, a atuação em ambientes industriais e de pesquisa. A gama de atividades ainda envolvem o projeto, planejamento e controle de produção; desenvolvimento de produtos; operações e controle de processos químicos; saneamento básico; química forense; tratamento de resíduos industriais; segurança; gestão de meio ambiente e, em alguns casos específicos, vendas, assistência técnica, planejamento industrial e direção de empresas.[47] O primeiro laboratório para ensino de Química em Portugal foi o Laboratório Chimico instalado na Universidade de Coimbra. Foi edificado em 1772 a mando do Marquês de Pombal e hoje abriga o Museu da Ciência da Universidade de Coimbra.[48]
No Brasil, a Química se tornou uma disciplina em uma série de instituições após a chegada da corte portuguesa ao país em 1808. A primeira dessas disciplinas foi ministradas em cursos existentes na Real Academia Militar, fundada em 1810 no Rio de Janeiro pelo príncipe regente João VI de Portugal. Devido à falta de pessoal local para o cargo de professor de Química, o químico britânico Daniel Gardner foi contratado para exercer essa função. Ele ocupou a cadeira até a sua aposentadoria, em 1825.[49]

Os cursos de Química são generalistas - privilegiando a Química Orgânica, Química Inorgânica, Química Analítica, Físico-Química e Bioquímica -, com aulas teóricas e experimentais. A primeira metade do curso contempla também disciplinas como Cálculo Diferencial e Integral e Física, fundamentais para aprofundamento em determinados assuntos. Muitos faculdades permitem a escolha de opções no decorrer da graduação: formação de professores de Química (com disciplinas pedagógicas e estágio em estabelecimentos de ensino); Química Básica (para os alunos que possuem interesse em pesquisa básica e/ou desejam seguir os estudos na pós-graduação e a Química Industrial (o aluno cursa um rol de disciplinas que permitem uma visão sobre operações industriais, além do estágio em indústrias). Outras faculdades oferecem a habilitação já na matrícula, como Química Industrial, Tecnológica, Ambiental, de Alimentos, Petróleo ou Têxtil.[50] Dentre as importantes sociedades científicas nas comunidades lusófonas, podem ser citadas a Sociedade Brasileira de Química[51] e a Sociedade Portuguesa de Química.[52] Essas instituições são destinadas a cuidar de assuntos de mérito da Química, em seus aspectos científicos, epistemológicos, metodológicos e pragmáticos. Essas sociedades são abertas a participação de profissionais em Química e áreas afins e atuam no desenvolvimento e consolidação da comunidade, na divulgação da Química e de suas relações, aplicações e consequências para o desenvolvimento do país e para a melhoria da qualidade de vida dos cidadãos.

Diversas competições científicas, nacionais e internacionais, foram criadas para estimular o interesse pela química no meio estudantil. Desde 1986, o Brasil promove a Olimpíada Brasileira de Química. A primeira Olimpíada Iberoamericana de Química foi realizada no ano de 1995, em Mendoza (Argentina). Em 1968, a cidade de Praga, na então República Tcheca, sediou a primeira Olimpíada Internacional de Química.
O ano de 2011 foi considerado o Ano Internacional da Química, em resultado da reunião da Assembleia Geral das Nações Unidas (AGNU), que decorreu em 31 de julho a 6 de agosto de 2009, em Glasgow, na Escócia. A agenda de comemorações foi organizada pela União Internacional de Química Pura e Aplicada (IUPAC) e pela Organização das Nações Unidas para a Educação, a Ciência e a Cultura (UNESCO). O objetivo do Ano Internacional da Química foi celebrar as contribuições da química para o bem-estar da humanidade, com ênfase à importância da química para os recursos naturais sustentáveis. Em 2011 também foi comemorado o centenário da primeira vez que o Prêmio Nobel de Química foi entregue a uma mulher, Marie Curie, por suas pesquisas com radioisótopos. Foi a primeira vez também que uma mulher ganhava uma das cinco modalidades do prêmio. Este fato motivou diversas celebração pela contribuição das mulheres à ciência durante a Ano da Química.
O Prêmio Nobel é atribuído anualmente pela Academia Real das Ciências da Suécia a diversos cientistas de diferentes campos, entre eles a química. A premiação foi criada a partir do desejo de Alfred Nobel de galardoar personalidades que contribuíssem para o bem-estar da humanidade. Este prêmio é administrado pela Fundação Nobel, adjudicado por um comité constituído por cinco membros eleitos pela Academia Real das Ciências da Suécia. O primeiro Nobel de Química foi atribuído em 1901 a Jacobus Henricus van' t Hoff, dos Países Baixos, por sua descoberta das leis da dinâmica da Química e pressão osmótica em soluções.[53]
Profissionais da Química
No Brasil, atualmente são considerados profissionais afins da ciências químicas, com registro nos Conselhos Federais e Regionais de Química:
- Engenharia Química e semelhantes (Engenharia de alimentos, por exemplo);
- Bacharel em Química;
- Bacharel em Química Industrial ou Química tecnológica;
- Bacharel em Bioquímica;
- Licenciado em Química;
- Técnicos em modalidades da química;
- Tecnólogos em modalidades da química, tais como Processos Químicos.[54]
Ver também
- Ano Internacional da Química
- Associações de Química
- Chemical Abstracts
- Engenharia Química
- Indústrias químicas
- Instituições de Química
- Lista de químicos
- Nobel de Química
- Periódicos de química
- Tabela periódica
Referências
- ↑ Enciclopédia Mirador do Brasil, v.17, 1981 ISBN 85-7026-018-0
- ↑ «Chemistry» (em English). Encyclopædia Britannica. Consultado em 14 de janeiro de 2013
- ↑ «Chemistry» (em English). Dictionary.com. Consultado em 14 de janeiro de 2013
- ↑ Roberts, L. «The Telegraph History of Aspirin» (em English). Telegraph. Consultado em 27 de dezembro de 2012
- ↑ Analytical Sciencess, 2001, v.17 supplement [1] Arquivado em 23 de agosto de 2012, no Wayback Machine., Basic Education in Analytical Chemistry
- ↑ Talanta Volume 51, Issue 5, p921-933 [2], Review of analytical next term measurements facilitated by drop formation technology
- ↑ TrAC Trends in Analytical Chemistry Volume 21, Issues 9-10, Pages 547-557 [3], History of gas chromatography
- ↑ 8,0 8,1 Erro de script: Nenhum módulo desse tipo "Citar enciclopédia".
- ↑ de Réaumur, RAF (1752). «Observations sur la digestion des oiseaux». Histoire de l'academie royale des sciences. 1752: 266, 461
- ↑ Williams, H. S. (1904) A History of Science: in Five Volumes. Volume IV: Modern Development of the Chemical and Biological Sciences Harper and Brothers (New York)
- ↑ UFRJ. Cronologia dos eventos em enzimologia Arquivado em 22 de junho de 2013, no Wayback Machine.. Acesso: 4/5/2009
- ↑ «Matter: Atoms from Democritus to Dalton» by Anthony Carpi, Ph.D.
- ↑ R. Penrose (1991). «The mass of the classical vacuum». In: S. Saunders, H.R. Brown. The Philosophy of Vacuum. [S.l.]: Oxford University Press. p. 21. ISBN 0-19-824449-5
- ↑ «Matter (physics)». McGraw-Hill's Access Science: Encyclopedia of Science and Technology Online. Consultado em 24 de maio de 2009. Arquivado do original em 17 de junho de 2011
- ↑ J. Mongillo (2007). Nanotechnology 101. [S.l.]: Greenwood Publishing. p. 30. ISBN 0-313-33880-9
- ↑ IUPAC Gold Book Definition Arquivado em 30 de setembro de 2009, no Wayback Machine.
- ↑ «chemical bonding». Britannica. Encyclopædia Britannica. Consultado em 1 de novembro de 2012
- ↑ IUPAC, Compêndio de Terminologia Química, 2ª ed. ("Gold Book"). Compilado por A. D. McNaught e A. Wilkinson. Blackwell Scientific Publications, Oxford (1997). Versão online: "molecule" (1994) criado por M. Nic, J. Jirat, B. Kosata; atualizações compiladas por A. Jenkins. ISBN 0-9678550-9-8.
- ↑ «Molecule» (em English). Encyclopædia Britannica on-line. Consultado em 14 de janeiro de 2013
- ↑ «The Lewis Acid-Base Concept». Apsidium (em English). Consultado em 14 de janeiro de 2013. Arquivado do original em 27 de maio de 2008
- ↑ «History of Acidity» (em English). Bbc.co.uk. Consultado em 14 de janeiro de 2013
- ↑ Covington, A. K.; Bates, R. G.; Durst, R. A. (1985). «Definitions of pH scales, standard reference values, measurement of pH, and related terminology» (PDF). Pure Appl. Chem. 57 (3): 531–542. doi:10.1351/pac198557030531
- ↑ Nic, M; Jirat, J.; Kosata, B. (2006). «IUPAC Compendium of Chemical Terminology» (em English). IUPAC. doi:10.1351/goldbook.C01033. Consultado em 13 de janeiro de 2013
- ↑ SILVA, R. R.; ROCHA-FILHO, R. C. (maio de 1995). «Mol: uma nova terminologia» (PDF). São Paulo. Quím. Nova Esc. (1): 12-14
- ↑ «INMETRO Unidades legais de medida». Consultado em 27 de agosto de 2010
- ↑ «Current definitions of the SI base units». National Institute of Standards and Technology. 2019. Consultado em 3 de janeiro de 2022
- ↑ IUPAC, Compêndio de Terminologia Química, 2ª ed. ("Gold Book"). Compilado por A. D. McNaught e A. Wilkinson. Blackwell Scientific Publications, Oxford (1997). Versão online: "chemical equilibrium" (2006–) criado por M. Nic, J. Jirat, B. Kosata; atualizações compiladas por A. Jenkins. ISBN 0-9678550-9-8.
- ↑ Reilly, Michael. (2007). Mechanical force induces chemical reaction, NewScientist.com news service, Reilly Arquivado em 25 de março de 2007, no Wayback Machine.
- ↑ «Changing States of Matter» - Chemforkids.com
- ↑ «Careers in Chemistry: Inorganic Chemistry» (em English). American Chemical Society. Consultado em 14 de janeiro de 2013. Arquivado do original em 29 de outubro de 2012
- ↑ Holler, F. James; Skoog, Douglas A.; West, Donald M. (1996). Fundamentals of analytical chemistry. Philadelphia: Saunders College Pub. ISBN 0-03-005938-0
- ↑ Hulanicki A. (1987). Reactions of Acids and Bases in Analytical Chemistry. [S.l.]: Horwood. ISBN 0-85312-330-6
- ↑ E. J. King "Qualitative Analysis and Electrolytic Solutions" 1959, Harcourt, Brace, and World, New York.
- ↑ Richard F. and Sally J. Daley, Organic Chemistry, Online organic chemistry textbook. Ochem4free.info
- ↑ "chemistry of industrial polymers", Encyclopædia Britannica (2006)
- ↑ Lehninger, A.L.; Nelson, D.L.; Cox, M.M. (2007) Lehninger: Princípios de Bioquímica, 4a. Edição, Editora Sarvier.
- ↑ Voet, D.; Voet, J.G. (2008) Fundamentos de Bioquímica - A Vida em Nível Molecular, 2a. Edição, Editora Artmed.
- ↑ Krukemberghe Fonseca. «Ácidos Nucleicos». R7. Brasil Escola. Consultado em 3 de novembro de 2012
- ↑ Stryer et al., p. 634.
- ↑ Stryer et al., pp. 625–26.
- ↑ 41,0 41,1 Sociedade Brasileira de Química. AVALIAÇÃO DO ESTADO DE OXIDAÇÃO DO NÍQUEL NO SISTEMA Ni-DMG EM PRESENÇA DE ESPÉCIES OXIDANTES. - Clarivaldo Santos de Sousa, Zênis Novais da Rocha, Mauro Korn. Visitado em 1 de Setembro de 2015.
- ↑ «YouTube» - Vídeo: Sonochemistry & Cavitation. (em inglês) Visitado em 4 de Julho de 2018.
- ↑ «YouTube» - Vídeo: Síntesis de Nanopartículas de TiO2 por Sonoquímica, Parte 1. (em castelhano) Visitado em 4 de Julho de 2018.
- ↑ Carlos Dias (1999). «65 anos. Em cada perna». Revista Superinteressante. Consultado em 10 de fevereiro de 2013
- ↑ Torresi; et al. (2009). «Química é uma ciência em expansão». Química Nova. 32 (8). ISSN 0100-4042. Consultado em 10 de fevereiro de 2013
- ↑ Lúcia Helena de Oliveira (1991). «A química presente nas atividade do dia-a-dia». Revista Superinteressante. Consultado em 10 de fevereiro de 2013
- ↑ Conselho Regional de Química - O que faz um químico?
- ↑ Teresa Firmino (5 de dezembro de 2006). «Laboratório Chimico abre hoje como museu de ciência». Público. Consultado em 10 de fevereiro de 2013
- ↑ Santos; et al. (2011). «O primeiro curso regular de química no Brasil». Química Nova. 34 (2). ISSN 0100-4042. doi:dx.doi.org/10.1590/S0100-40422011000200034 Verifique
|doi=(ajuda). Consultado em 10 de fevereiro de 2013 - ↑ «Guia Abril de Estudante - Química». Consultado em 10 de fevereiro de 2013
- ↑ Bechara & Vietler; et al. (1997). «Criação e consolidação da Sociedade Brasileira de Química (SBQ)». Química Nova. 20 (especial). ISSN 0100-4042. doi:dx.doi.org/10.1590/S0100-40422011000200034 Verifique
|doi=(ajuda). Consultado em 10 de fevereiro de 2013 - ↑ «Cem anos de Sociedade Portuguesa de Química». Ciência Hoje. 27 de dezembro de 2010. Consultado em 10 de fevereiro de 2013
- ↑ «Robert J. Lefkowitz e Brian K. Kobilka ganham o prêmio Nobel da Química». Ciência Hoje. 27 de dezembro de 2010. Consultado em 10 de fevereiro de 2013
- ↑ «Tecnologia em Processos Químicos». Universidade Tecnológica Federal do Paraná UTFPR (em português). Consultado em 19 de maio de 2020
Bibliografia
- Atkins, Peter William; Paula, Julio de (2006). Atkins' Physical Chemistry (em English) 8 ed. [S.l.]: Oxford University Press. p. 1053. ISBN 9780716771111. Consultado em 14 de janeiro de 2013
- Atkins, Peter William; Jones, Loretta (2008). Chemical Principles: The Quest for Insight (em English) 4 ed. [S.l.]: W.H. Freeman. p. 787. ISBN 9780716799030
- Brown, Theodore L; Lemay, H. Eugene; Bursten, Bruce Edward; Lemay, H (1999). Chemistry: The Central Science (em English) 8 ed. [S.l.]: Prentice Hall. ISBN 0-13-010310-1
- Brown, Theodore L; Bursten, Bruce Edward; Kemp, Kenneth C; LeMay, Harold Eugene; Nelson, John H (2003). Chemistry – the Central Science (em English) 9 ed. Nova Jérsei: Prentice Hall. p. 592. ISBN 9780130669971. Consultado em 14 de janeiro de 2013
- Brown, Theodore L; Bursten, Bruce Edward; LeMay, Harold Eugene; Murphy, Catherine J; Woodward, Patrick (2009). Chemistry – the Central Science (em English) 11 ed. Nova Jérsei: Prentice Hall. p. 592. ISBN 0-13-236489-1. Consultado em 14 de janeiro de 2013
- Chandler, David (1987). Introduction to Modern Statistical Mechanics (em English). Nova Iorque: Oxford University Press. p. 274. ISBN 9780195042771. Consultado em 14 de janeiro de 2013
- Chandra, Sulekh (2005). Comprehensive Inorganic Chemistry (em English). Nova Déli: New Age Publishers. p. 324. ISBN 9788122415124. Consultado em 14 de janeiro de 2013
- Chang, Raymond (1998). Chemistry (em English) 6 ed. Nova Iorque: McGraw Hill. ISBN 0-07-115221-0
- Ebbin, Darrell, D (1990). General Chemistry (em English) 3 ed. Boston: Houghton Mifflin. ISBN 0-395-43302-9
- Gibbs, Josiah Willard (1876). On the Equilibrium of Heterogeneous Substances (em English). [S.l.]: American Journal of Science and Arts. p. 458. Consultado em 14 de janeiro de 2013
- Halal, John (2008). «Chapter 8: General Chemistry». Milady's Hair Structure and Chemistry Simplified (PDF) 5 ed. [S.l.]: Milady Publishing. ISBN 1-4283-3558-7. Consultado em 14 de janeiro de 2013
- Hill, John W.; Petrucci, Ralph H.; McCreary, Terry W.; Perry, Scott S (2005). General Chemistry (em English) 4 ed. Upper Saddle River: Prentice Hall. p. 1200. ISBN 9780131402836. Consultado em 14 de janeiro de 2013
- Laidler, Keith James (1993). The World of Physical Chemistry (em English). Oxford: Oxford University Press. p. 476. ISBN 9780198555971. Consultado em 14 de janeiro de 2013
- Landau, Lev Davidovich; Lifshitz, E. M.; Pitaevskii, L. P (1980). Statistical Physics (em English) 3 ed. Nova Iorque: Elsevier Butterworth Heinemann. p. 387. ISBN 9780750626361. Consultado em 14 de janeiro de 2013
- Lehn, Jean-Marie (1995). Supramolecular Chemistry: Concepts and Perspectives (em English). Weinheim: Wiley. p. 281. ISBN 9783527293117. Consultado em 14 de janeiro de 2013
- Leigh, G. J; International Union of Pure and Applied Chemistry, Commission on the Nomenclature of Inorganic Chemistry (1990). Nomenclature of Organic Chemistry – Recommendations 1990 (em English). Oxford: Blackwell Scientific Publications. ISBN 0-08-022369-9
- Mills, Ian; Cvitaš, Tomislav; Kallay, Nicola; Klaus, Homann; Kuchitsu, Kozo (1993). Quantities, units and symbols in physical chemistry (em English) 2 ed. Oxford: John Wiley & Sons. p. 166. ISBN 9780632035830. Consultado em 14 de janeiro de 2013. Arquivado do original em 18 de fevereiro de 2008
- Modell, Michael; Reid, Robert C (1974). Thermodynamics and Its Applications (em English) 0-13-914861-2 ed. Englewood Cliffs: Prentice-Hall
- Morrison, Robert T; Boyd, Robert N; Boyd, Robert K (1992). Organic Chemistry (em English) 6 ed. [S.l.]: Benjamin Cummings. ISBN 0-13-643669-2
- Pauling, Linus (1970). General Chemistry (em English). Nova Iorque: Dover Publications. ISBN 0-486-65622-5
- Reinhardt, Carsten (2001). Chemical Sciences in the 20th Century: Bridging Boundaries (em English). [S.l.]: Wiley-VCH
- Roberts, John D; Caserio, Marjorie C (1964). Basic Principles of Organic Chemistry (em English). [S.l.]: W. A. Benjamin
- Schmidt, Lanny D (2005). The Engineering of Chemical Reactions (em English) 2 ed. Nova Iorque: Oxford University Press. ISBN 0-19-516925-5
- Stryer, L; Tymoczko, J. L.; Berg, J. M (2004). Bioquímica 5 ed. [S.l.]: Guanabara
- Vucinich, Alexander (1963). Science in Russian culture (em English). [S.l.]: Stanford University Press. ISBN 0-8047-0738-3. Consultado em 14 de janeiro de 2013
- Whitten, Kenneth W; Davis, Raymond E; Peck, M. Larry (2000). General Chemistry (em English) 6 ed. Fort Worth: Saunders College Publishing/Harcourt College Publishers. ISBN 978-0-03-072373-5
- Zumdahl, Steven S (1997). Chemistry (em English) 4 ed. Boston: Houghton Mifflin. ISBN 0-669-41794-7








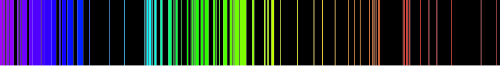


 " class="attachment-atbs-s-4_3 size-atbs-s-4_3 wp-post-image" alt="O que estudar para o enem 2023">
" class="attachment-atbs-s-4_3 size-atbs-s-4_3 wp-post-image" alt="O que estudar para o enem 2023"> " class="attachment-atbs-s-4_3 size-atbs-s-4_3 wp-post-image" alt="Qual melhor curso para fazer em 2023">
" class="attachment-atbs-s-4_3 size-atbs-s-4_3 wp-post-image" alt="Qual melhor curso para fazer em 2023"> " class="attachment-atbs-s-4_3 size-atbs-s-4_3 wp-post-image" alt="Enem: Conteúdos E Aulas On-Line São Opção Para Os Estudantes">
" class="attachment-atbs-s-4_3 size-atbs-s-4_3 wp-post-image" alt="Enem: Conteúdos E Aulas On-Line São Opção Para Os Estudantes"> " class="attachment-atbs-s-4_3 size-atbs-s-4_3 wp-post-image" alt="Como Fazer Uma Carta De Apresentação">
" class="attachment-atbs-s-4_3 size-atbs-s-4_3 wp-post-image" alt="Como Fazer Uma Carta De Apresentação"> " class="attachment-atbs-s-4_3 size-atbs-s-4_3 wp-post-image" alt="Como Escrever Uma Boa Redação">
" class="attachment-atbs-s-4_3 size-atbs-s-4_3 wp-post-image" alt="Como Escrever Uma Boa Redação"> " class="attachment-atbs-s-4_3 size-atbs-s-4_3 wp-post-image" alt="Concurso INSS edital 2022 publicado">
" class="attachment-atbs-s-4_3 size-atbs-s-4_3 wp-post-image" alt="Concurso INSS edital 2022 publicado">


