| style="background: #Predefinição:Chembox fundo; text-align: center;" colspan="2" | Sulfeto de sódio Alerta sobre risco à saúde | |
|---|---|
| |

| |
| Outros nomes | Sulfeto dissódico |
| style="background: #Predefinição:Chembox fundo; text-align: center;" colspan="2" | Propriedades | |
| Fórmula molecular | Na2S |
| Massa molar | 78,0452 g/mol (anidro) 240.18 g/mol (nonaidrato) |
| Aparência | sólido incolor higroscópico |
| Densidade | 1,856 g/cm3 (anidro) 1,58 g/cm3 (pentaidrato) 1,43 g/cm3 (nonaidrato) |
| Ponto de fusão |
1176 °C (anidro) |
| Solubilidade em água | 18,6 g/100 mL (20 °C) 39 g/100 mL (50 °C) |
| Solubilidade | insolúvel em éter levemente solúvel em álcool |
| style="background: #Predefinição:Chembox fundo; text-align: center;" colspan="2" | Estrutura | |
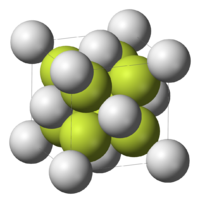
| Estrutura cristalina | Antifluorita (cúbico), cF12 |
| Grupo de espaço | Fm3m, No. 225 |
| Geometria de coordenação |
Tetrahédrico (Na+); cúbico (S2–) |
| style="background: #Predefinição:Chembox fundo; text-align: center;" colspan="2" | Riscos associados | |
| MSDS | ICSC 1047 |
| Classificação UE | Corrosivo (C) Perigoso para o ambiente (N) |
| Índice UE | 016-009-00-8 |
| NFPA 704 | |
| Frases R | R31, R34, R50 |
| Frases S | S1/2, S26, S45, S61 |
| Temperatura de auto-ignição |
>480 °C |
| style="background: #Predefinição:Chembox fundo; text-align: center;" colspan="2" | Compostos relacionados | |
| Outros aniões/ânions | Óxido de sódio Seleneto de sódio Telureto de sódio Cloreto de sódio Sulfito de sódio |
| Outros catiões/cátions | Sulfeto de lítio Sulfeto de potássio Sulfeto de magnésio |
| Compostos relacionados | Hidrossulfeto de sódio |
| style="background: #Predefinição:Chembox fundo; text-align: center;" colspan="2" | Página de dados suplementares | |
| Estrutura e propriedades | n, εr, etc. |
| Dados termodinâmicos | Phase behaviour Solid, liquid, gas |
| Dados espectrais | UV, IV, RMN, EM |
| style="background: #Predefinição:Chembox fundo; text-align: center;" colspan="2" | Exceto onde denotado, os dados referem-se a materiais sob condições normais de temperatura e pressão Referências e avisos gerais sobre esta caixa. Alerta sobre risco à saúde. | |
Sulfeto de sódio é o nome utilizado para designar o composto químico Na2S e seu hidrato mais comum: Na2S.9H2O. Ambos formam solução incolor em água (sais solúveis) e fortemente alcalinas. Quando expostas a umidade do ar (e ao dióxido de carbono nele contido), Na2S e seus hidratos emitem sulfeto de hidrogênio, um gás muito tóxico e com cheiro que se assemelha ao de ovos podres.
Estrutura
O Na2S adota a estrutura antifluorita,[1][2] o que significa que o Na+ central ocupa sítios do fluoreto na rede CaF2, e o S2− maior ocupa os sítios para Ca2+. Em solução, o sal, por definição, dissocia-se. O diânion S2− não, entretanto, existe em apreciável quantidade ema água. Sulfeto é forte demais como base para coexistir com água. Então, o processo de dissolução pode ser descrito como segue-se:
- Na2S(s) + H2O(l) → 2Na+(aq) + HS− + OH−
Sulfeto de sódio pode oxidar-se quando aquecido ao ar a carbonato de sódio e dióxido de enxofre:
- 2 Na2S + 3 O2 + 2 CO2 → 2 Na2CO3 + 2 SO2
Produção
Industrialmente Na2S é produzido pela redução de Na2SO4 (sulfato de sódio) com carbono, sob a forma de carvão:[3]
- Na2SO4 + 4 C → Na2S + 4 CO
Em laboratório, os sal anidro pode ser obtido por redução de enxofre com sódio anidro em amônia. Alternativamente, o enxofre pode ser reduzida por sódio em THF seco com quantidade catalitica de naftaleno (traços):[4]
- 2 Na + S → Na2S
Segurança
Na2S e seus hidratos são perigosos e devem ser manuseados apenas por especialistas. Cáustico, fortemente alcalino, causa queimaduras na pele se manuseado sem cuidado. Com ácidos, reage rapidamente a produzir sulfeto de hidrogênio, que é um gás altamente tóxico.
Uso
É aplicado na depilação de couro por queimar e limpar camadas, até a indústria metalúrgica, onde participa da flotação do zinco e cobre e no processo Kraft da celulose.
Referências
- ↑ Zintl, E; Harder, A; Dauth, B. (1934). «Gitterstruktur der oxyde, sulfide, selenide und telluride des lithiums, natriums und kaliums». Z. Elektrochem. Angew. Phys. Chem. 40: 588–93
- ↑ Wells, A.F. (1984) Structural Inorganic Chemistry, Oxford: Clarendon Press. ISBN 0-19-855370-6.
- ↑ Holleman, A. F.; Wiberg, E. "Inorganic Chemistry" Academic Press: San Diego, 2001. ISBN 0-12-352651-5.
- ↑ So, J.-H; Boudjouk, P; Hong, Harry H.; Weber, William P. (1992). «Hexamethyldisilathiane». Inorg. Synth. 29. 30 páginas. doi:10.1002/9780470132609.ch11





 " class="attachment-atbs-s-4_3 size-atbs-s-4_3 wp-post-image" alt="O que estudar para o enem 2023">
" class="attachment-atbs-s-4_3 size-atbs-s-4_3 wp-post-image" alt="O que estudar para o enem 2023"> " class="attachment-atbs-s-4_3 size-atbs-s-4_3 wp-post-image" alt="Qual melhor curso para fazer em 2023">
" class="attachment-atbs-s-4_3 size-atbs-s-4_3 wp-post-image" alt="Qual melhor curso para fazer em 2023"> " class="attachment-atbs-s-4_3 size-atbs-s-4_3 wp-post-image" alt="Enem: Conteúdos E Aulas On-Line São Opção Para Os Estudantes">
" class="attachment-atbs-s-4_3 size-atbs-s-4_3 wp-post-image" alt="Enem: Conteúdos E Aulas On-Line São Opção Para Os Estudantes"> " class="attachment-atbs-s-4_3 size-atbs-s-4_3 wp-post-image" alt="Como Fazer Uma Carta De Apresentação">
" class="attachment-atbs-s-4_3 size-atbs-s-4_3 wp-post-image" alt="Como Fazer Uma Carta De Apresentação"> " class="attachment-atbs-s-4_3 size-atbs-s-4_3 wp-post-image" alt="Como Escrever Uma Boa Redação">
" class="attachment-atbs-s-4_3 size-atbs-s-4_3 wp-post-image" alt="Como Escrever Uma Boa Redação"> " class="attachment-atbs-s-4_3 size-atbs-s-4_3 wp-post-image" alt="Concurso INSS edital 2022 publicado">
" class="attachment-atbs-s-4_3 size-atbs-s-4_3 wp-post-image" alt="Concurso INSS edital 2022 publicado">


