| style="background: #Predefinição:Chembox fundo; text-align: center;" colspan="2" | Ácido nítrico Alerta sobre risco à saúde | |
|---|---|
| |
| |
| |
| |
| Nome IUPAC | Ácido nitrico |
| style="background: #Predefinição:Chembox fundo; text-align: center;" colspan="2" | Propriedades | |
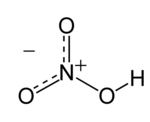
| Fórmula molecular | HNO3 |
| Massa molar | 63,012 g/mol |
| Aparência | Líquido de incolor a amarelo |
| Densidade | 1,51 g·ml-1 (20 °C)[1] |
| Ponto de fusão |
-42 °C [1] |
| Ponto de ebulição |
83 °C (puro) |
| Solubilidade em água | Completamente miscível |
| Pressão de vapor | 400 Pa (293 K) |
| Acidez (pKa) | -1,4 |
| Índice de refracção (nD) | 1,397 (16,5 °C) |
| Viscosidade | 0,88 mPa⋅s (20 °C) |
| Momento dipolar | 2,17 ± 0,02 D |
| style="background: #Predefinição:Chembox fundo; text-align: center;" colspan="2" | Termoquímica | |
| Entalpia padrão de formação ΔfH |
-174,1 kJ/mol |
| Entropia molar padrão S |
155,6 J/K mol |
| Capacidade calorífica molar Cp 298 |
109,9 J/K mol |
| style="background: #Predefinição:Chembox fundo; text-align: center;" colspan="2" | Farmacologia | |
| style="background: #Predefinição:Chembox fundo; text-align: center;" colspan="2" | Riscos associados | |
| MSDS | ICSC 0183 |
| Classificação UE | |
| Índice UE | 007-004-00-1 |
| NFPA 704 | |
| Frases R | R8, R35 |
| Frases S | S1/2, S23, S26, S36, S45 |
| Ponto de fulgor | Não inflamável |
| style="background: #Predefinição:Chembox fundo; text-align: center;" colspan="2" | Compostos relacionados | |
| Outros catiões/cátions | Nitrato de sódio Nitrato de potássio Nitrato de amônio Nitrato de metila |
| Oxiácidos relacionados | Ácido nitroso Ácido carbônico Ácido fosfórico |
| Compostos relacionados | Pentóxido de dinitrogênio Nitramida (NH2NO2) |
| style="background: #Predefinição:Chembox fundo; text-align: center;" colspan="2" | Página de dados suplementares | |
| Estrutura e propriedades | n, εr, etc. |
| Dados termodinâmicos | Phase behaviour Solid, liquid, gas |
| Dados espectrais | UV, IV, RMN, EM |
| style="background: #Predefinição:Chembox fundo; text-align: center;" colspan="2" | Exceto onde denotado, os dados referem-se a materiais sob condições normais de temperatura e pressão Referências e avisos gerais sobre esta caixa. Alerta sobre risco à saúde. | |
O ácido nítrico, que tem a fórmula molecular HNO3, é um ácido de elevado grau de ionização e volátil à temperatura ambiente. É produzido industrialmente pelo processo Ostwald e é também conhecido como ácido azótico ou água-forte.
Características e propriedades
Propriedades físicas
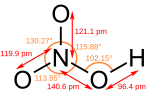
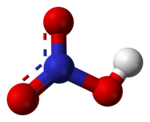
O ácido nítrico puro é um líquido viscoso, incolor e inodoro. Frequentemente, distintas impurezas o colorem de amarelo-acastanhado, quando puro se torna cristalino. A temperatura ambiente libera fumaças (fumos) vermelhos ou amareladas. O ácido nítrico concentrado tinge a pele humana de amarelo ao contato, devido a uma reação com a cisteína presente na queratina da pele.
Propriedades químicas
O ácido nítrico é considerado um ácido forte, sendo também bastante corrosivo.
Sendo um ácido típico, o ácido nítrico reage com os metais alcalinos, óxidos básicos e carbonatos, formando sais, como o nitrato de amônio. Devido à sua natureza oxidante, o ácido nítrico geralmente não doa prótons (isto é, ele não libera hidrogênio) na reação com metais e o sal resultante normalmente está no mais alto estado de oxidação. Por essa razão, pode-se esperar forte corrosão, que deve ser evitada pelo uso apropriado de metais ou ligas resistentes à corrosão.
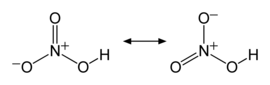
Ácido nítrico tem uma constante de dissociação ácida (pKa) de -1.4: em solução aquosa, ele ioniza quase completamente (93%, a 0,1 mol/L) em íons nitrato (
- REDIRECT Predefinição:FormulaQuimica) e prótons hidratados, conhecidos como íons hidrônios (
- REDIRECT Predefinição:FormulaQuimica).
- REDIRECT Predefinição:FormulaQuimica +
- REDIRECT Predefinição:FormulaQuimica →
- REDIRECT Predefinição:FormulaQuimica +
- REDIRECT Predefinição:FormulaQuimica
Quando ebulido em presença de luz, mesmo à temperatura ambiente, há uma decomposição parcial com a formação de dióxido de nitrogênio, seguindo a reação:
- 4
- REDIRECT Predefinição:FormulaQuimica → 2
- REDIRECT Predefinição:FormulaQuimica + 4
- REDIRECT Predefinição:FormulaQuimica + O2 (72 °C)
Suas reações com compostos como os cianetos, carbetos, e pós metálicos podem ser explosivas.
Fortemente oxidante, é incompatível com a maioria dos produtos orgânicos. As reações do ácido nítrico com muitos compostos orgânicos, como a terebentina ou o álcool etílico, são violentas, a mistura sendo hipergólica (quer dizer, auto-inflamável).
Os sais do ácido nítrico (que contém o íon nitrato) se chamam nitratos. A quase totalidade deles são muito estáveis em água. O ácido nítrico e seus sais, os nitratos, não devem ser confundidos com o ácido nitroso e seus sais, os nitritos.
Aplicações industriais
O ácido nítrico concentrado, normalmente usado em laboratórios e aplicações industriais, é a solução aquosa de ponto de ebulição constante, contendo 68% de ácido nítrico (42,25º Baumé).
Ácido nítrico, especialmente concentrado (solução aquosa em teor de nítrico maior que 70% máximo) é utilizado na indústria de explosivos, apenas de forma gasosa.
O ácido nítrico fumegante é o ácido concentrado, 85,7% (47º Be), contendo óxidos de nitrogênio livres, dissolvidos, que elevem a concentração para até mais de 96% em peso. Este ácido deriva seu nome porque fumega quando exposto ao ar. Apesar de mais instável quimicamente que o ácido concentrado normal, reage mais vigorosamente com outras substâncias, devido à presença dos óxidos nitrosos livres. Forma uma mistura azeotrópica com a água a 68%.
A principal aplicação do ácido nítrico é na produção de fertilizantes.
Entre os sais do ácido nítrico estão incluídos importantes compostos como o nitrato de potássio (nitro ou salitre empregado na fabricação de pólvora) e o nitrato de amônio como fertilizante.
O ácido nítrico também pode ser utilizado na obtenção de um éster, em um processo chamado de esterificação:
- Ácido nítrico + Álcool metílico → Nitrato de metila + água
- NO2 - OH + HO - CH3 → NO2- O - CH3 + H2O
O ácido nítrico é utilizado na oxidação do ciclohexanol/ciclohexanona na produção de ácido adípico na cadeia do nylon.
Além destes usos, o ácido nítrico, em várias concentrações, é utilizado para fabricação de corantes, explosivos (destacadamente a nitroglicerina, a nitrocelulose, além do ácido pícrico), diversos ésteres orgânicos, fibras sintéticas, nitrificação de composto alifáticos e aromáticos, galvanoplastia, seda artificial, ácido benzóico, terylene, etc.
História
Os alquimistas chamavam de aqua fortis o ácido nítrico e aqua regia a mistura de ácido nítrico e clorídrico, conhecida pela sua capacidade de reagir quimicamente com ouro.
Produção
Modernamente o ácido nítrico é produzido a partir do processo de Ostwald, onde amônia é queimada com ar sob telas catalíticas de platina gerando monóxido de nitrogênio (NO), que oxidado com ar à dióxido de nitrogênio (NO2) é absorvido sob pressão em água formando ácido nítrico. O processo envolve altas temperaturas e pressões próximas da atmosférica.
Um processo anterior ao de Ostwald era o do arco voltaico, onde o próprio ar submetido a corrente elétrica reagia a 3000 °C formando NO. Outro processo anterior era a reação de nitrato de sódio com ácido sulfúrico. Ambos processos caíram em desuso no início do século XX com o barateamento da amônia produzida em larga escala pelo processo de Haber-Bosch.
A produção de ácido nítrico é fortemente poluidora, liberando gases NOx (geradores de chuva ácida) e N2O (gás de estufa). Diversos processos foram desenvolvidos, contudo, para o abatimento das emissões destes gases dentro das leis ambientais.
Referências
- ↑ 1,0 1,1 1,2 Sicherheitsdatenblatt (Merck) (die Angaben gelten für 100-prozentige Salpetersäure)









 " class="attachment-atbs-s-4_3 size-atbs-s-4_3 wp-post-image" alt="O que estudar para o enem 2023">
" class="attachment-atbs-s-4_3 size-atbs-s-4_3 wp-post-image" alt="O que estudar para o enem 2023"> " class="attachment-atbs-s-4_3 size-atbs-s-4_3 wp-post-image" alt="Qual melhor curso para fazer em 2023">
" class="attachment-atbs-s-4_3 size-atbs-s-4_3 wp-post-image" alt="Qual melhor curso para fazer em 2023"> " class="attachment-atbs-s-4_3 size-atbs-s-4_3 wp-post-image" alt="Enem: Conteúdos E Aulas On-Line São Opção Para Os Estudantes">
" class="attachment-atbs-s-4_3 size-atbs-s-4_3 wp-post-image" alt="Enem: Conteúdos E Aulas On-Line São Opção Para Os Estudantes"> " class="attachment-atbs-s-4_3 size-atbs-s-4_3 wp-post-image" alt="Como Fazer Uma Carta De Apresentação">
" class="attachment-atbs-s-4_3 size-atbs-s-4_3 wp-post-image" alt="Como Fazer Uma Carta De Apresentação"> " class="attachment-atbs-s-4_3 size-atbs-s-4_3 wp-post-image" alt="Como Escrever Uma Boa Redação">
" class="attachment-atbs-s-4_3 size-atbs-s-4_3 wp-post-image" alt="Como Escrever Uma Boa Redação"> " class="attachment-atbs-s-4_3 size-atbs-s-4_3 wp-post-image" alt="Concurso INSS edital 2022 publicado">
" class="attachment-atbs-s-4_3 size-atbs-s-4_3 wp-post-image" alt="Concurso INSS edital 2022 publicado">


