| style="background: #Predefinição:Chembox fundo; text-align: center;" colspan="2" | Ácido carbônico Alerta sobre risco à saúde | |
|---|---|
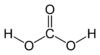
|

|
| Outros nomes | Carbon dioxide solution Carbonato de hidrogênio |
| style="background: #Predefinição:Chembox fundo; text-align: center;" colspan="2" | Propriedades | |
| Fórmula molecular | H2CO3 |
| Massa molar | 62.03 g/mol |
| Densidade | 0.0 g/cm3 (somente diluído) |
| Solubilidade em água | existe somente em solução |
| Acidez (pKa) | 6.36 (veja o texto) 10.25 |
| style="background: #Predefinição:Chembox fundo; text-align: center;" colspan="2" | Compostos relacionados | |
| Outros catiões/cátions | Carbonato de lítio |
| Ácidos relacionados | Ácido metanoico Ácido oxálico (etanodioico) Ácido bórico Ácido nítrico Ácido carbâmico (substituindo um -OH por -NH2) Ácido clorofórmico (substituindo um -OH por -Cl) Ácido ortocarbônico (C(OH)4, hipotético) |
| Compostos relacionados | Dióxido de carbono Ureia (substituindo os dois -OH por -NH2) Fosgênio (substituindo os dois -OH por -Cl) Carbonato de dimetila |
| style="background: #Predefinição:Chembox fundo; text-align: center;" colspan="2" | Página de dados suplementares | |
| Estrutura e propriedades | n, εr, etc. |
| Dados termodinâmicos | Phase behaviour Solid, liquid, gas |
| Dados espectrais | UV, IV, RMN, EM |
| style="background: #Predefinição:Chembox fundo; text-align: center;" colspan="2" | Exceto onde denotado, os dados referem-se a materiais sob condições normais de temperatura e pressão Referências e avisos gerais sobre esta caixa. Alerta sobre risco à saúde. |
O ácido carbônico (português brasileiro) ou carbónico (português europeu) é um composto químico de fórmula
- REDIRECT Predefinição:FormulaQuimica.[1] Considerado como um ácido fraco, ocorre no meio ambiente e é encontrado também na chuva, em refrigerantes, bebidas e no sangue.[2]
Produção
É formado quando se dilui o dióxido de carbono (gás carbônico, CO2) em água. Nestas condições é instável, mantendo um equilíbrio:[3]
- REDIRECT Predefinição:FormulaQuimica +
- REDIRECT Predefinição:FormulaQuimica Predefinição:Eqm
- REDIRECT Predefinição:FormulaQuimica
- REDIRECT Predefinição:FormulaQuimica Predefinição:→
- REDIRECT Predefinição:FormulaQuimica +
- REDIRECT Predefinição:FormulaQuimica
O ácido puro não pode ser isolado, apesar de poder ser produzido em soluções de éster a menos 30 graus Celsius. O ácido carbônico dá origem a dois sais: carbonatos e monohidrogenocarbonatos. É um ácido fraco porque tem preferência a se decompor, sobrando poucas moléculas para se ionizarem.O que faz com que a dissolução do solvente seja lenta, tornando as partículas cada vez menores, por isso existe turvação da água e é difícil que exista deposição da substância sólida que se pretende diluir.
Atualmente, existem pesquisas que revelam que o ácido carbônico puro pode ser obtido no estado sólido e no estado gasoso, na ausência total de água, que atua como catalisadora na sua decomposição. Encontrado na cerveja, água tônica. O ácido carbônico é responsável pelo gás nos refrigerantes. Decompõe-se em bolhas de água de carbono. Ka a 25 °C= 4.45E-7[3]
Referências
- ↑ Acid-Base Physiology 2.1 - Acid-Base Balance by Kerry Brandis
- ↑ Renata Branco (16 de agosto de 2011). «Aplicações do ácido carbônico na indústria». Manutenção & Suprimentos. Consultado em 15 de setembro de 2016. Arquivado do original em 20 de setembro de 2016
- ↑ 3,0 3,1 Predefinição:Greenwood&Earnshaw2nd
Bibliografia
- Welch, M. J.; Lifton, J. F.; Seck, J. A. (1969). "Tracer studies with radioactive oxygen-15. Exchange between carbon dioxide and water". J. Phys. Chem. 73 (335): 3351. doi:10.1021/j100844a033.
- Jolly, W. L. (1991). Modern Inorganic Chemistry (2nd Edn.). New York: McGraw-Hill. ISBN 0-07-112651-1.
- Moore, M. H.; Khanna, R. (1991). "Infrared and Mass Spectral Studies of Proton Irradiated H2O+Co2 Ice: Evidence for Carbonic Acid Ice: Evidence for Carbonic Acid". Spectrochimica Acta. 47A (2): 255–262. doi:10.1016/0584-8539(91)80097-3.
- W. Hage, K. R. Liedl; Liedl, E.; Hallbrucker, A; Mayer, E (1998). "Carbonic Acid in the Gas Phase and Its Astrophysical Relevance". Science. 279 (5355): 1332–1335. doi:10.1126/science.279.5355.1332. PMID 9478889.
- Hage, W.; Hallbrucker, A.; Mayer, E. (1995). "A Polymorph of Carbonic Acid and Its Possible Astrophysical Relevance". J. Chem. Soc. Farad. Trans. 91 (17): 2823–2826. doi:10.1039/ft9959102823.




 " class="attachment-atbs-s-4_3 size-atbs-s-4_3 wp-post-image" alt="O que estudar para o enem 2023">
" class="attachment-atbs-s-4_3 size-atbs-s-4_3 wp-post-image" alt="O que estudar para o enem 2023"> " class="attachment-atbs-s-4_3 size-atbs-s-4_3 wp-post-image" alt="Qual melhor curso para fazer em 2023">
" class="attachment-atbs-s-4_3 size-atbs-s-4_3 wp-post-image" alt="Qual melhor curso para fazer em 2023"> " class="attachment-atbs-s-4_3 size-atbs-s-4_3 wp-post-image" alt="Enem: Conteúdos E Aulas On-Line São Opção Para Os Estudantes">
" class="attachment-atbs-s-4_3 size-atbs-s-4_3 wp-post-image" alt="Enem: Conteúdos E Aulas On-Line São Opção Para Os Estudantes"> " class="attachment-atbs-s-4_3 size-atbs-s-4_3 wp-post-image" alt="Como Fazer Uma Carta De Apresentação">
" class="attachment-atbs-s-4_3 size-atbs-s-4_3 wp-post-image" alt="Como Fazer Uma Carta De Apresentação"> " class="attachment-atbs-s-4_3 size-atbs-s-4_3 wp-post-image" alt="Como Escrever Uma Boa Redação">
" class="attachment-atbs-s-4_3 size-atbs-s-4_3 wp-post-image" alt="Como Escrever Uma Boa Redação"> " class="attachment-atbs-s-4_3 size-atbs-s-4_3 wp-post-image" alt="Concurso INSS edital 2022 publicado">
" class="attachment-atbs-s-4_3 size-atbs-s-4_3 wp-post-image" alt="Concurso INSS edital 2022 publicado">


