| style="background: #Predefinição:Chembox fundo; text-align: center;" colspan="2" | c9, t11 conjugated linoleic acid Alerta sobre risco à saúde | |
|---|---|
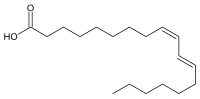
| |
| Nome IUPAC | (9Z,11E)-octadeca-9,11-dienoic acid |
| Outros nomes | Ácido Bovínico, Ácido Rumênico |
| style="background: #Predefinição:Chembox fundo; text-align: center;" colspan="2" | Propriedades | |
| Fórmula molecular | C18H32O2 |
| Massa molar | 280.44548 |
| style="background: #Predefinição:Chembox fundo; text-align: center;" colspan="2" | Compostos relacionados | |
| Compostos relacionados | ácido linoléico |
| style="background: #Predefinição:Chembox fundo; text-align: center;" colspan="2" | Página de dados suplementares | |
| Estrutura e propriedades | n, εr, etc. |
| Dados termodinâmicos | Phase behaviour Solid, liquid, gas |
| Dados espectrais | UV, IV, RMN, EM |
| style="background: #Predefinição:Chembox fundo; text-align: center;" colspan="2" | Exceto onde denotado, os dados referem-se a materiais sob condições normais de temperatura e pressão Referências e avisos gerais sobre esta caixa. Alerta sobre risco à saúde. | |
O ácido linoleico conjugado ou cLA é um termo genérico que denota um grupo de isômeros de ocorrência natural do ácido linoleico (18:2, ω-6) que diferem na posição ou geometria (cis ou trans) das suas ligações duplas[1]. Estão naturalmente presentes nos laticínios e carnes de ruminantes e possuem bioatividade no organismo humano.
Estruturas e propriedades químicas
O cLA foi primeiramente isolado da carne moída por Pariza e colaboradores em 1983[2] e desde então em torno de 20 isômeros do ácido graxo foram identificados na natureza.[3] O isômero cis-9,trans-11 18:2 ou c9,t11-cLA, conhecido como ácido rumênico devido a sua origem natural (rúmen), é o isômero natural mais abundante e mais bioativo, totalizando de 85-90% do conteúdo total de cLA nos laticínios. O outro isômero mais bem estudado e que também está presente nos laticínios é o trans-10,cis-12 18:2 ou t10,c12-cLA; presente em menores concentrações (cerca de 1% do total de cLA no leite). Vale ressaltar que o cLA não é considerado um tipo de gordura trans, apesar de possuir essa configuração, pois não apresenta o mesmo efeito da gordura trans produzida industrialmente por hidrogenação catalítica sobre a lipoproteína de baixa densidade e sobre doenças cardiovasculares.
As ligações duplas conjugadas são mais ativas quimicamente, portanto certos isômeros geométricos são facilmente susceptíveis a polimerização, oxidação, reações de adição e reações de Diels-Alder.[3]
Além disso, as moléculas que possuem ligações duplas conjugadas têm seu espectro de absorção alterado e que pode ser detectado pela espectroscopia UV/Visível.[4]
Biossíntese em Ruminantes
O rúmen é o primeiro compartimento digestivo em ruminantes.[5] O rúmen leva ao omaso, ao abomaso, e em seguida aos intestinos delgado e grosso, sequencialmente. Bactérias e fungos anaeróbicos, arqueas e protozoários ciliados são microorganismos que colonizam o rúmen,[6] a partir das partículas de ração ingeridas. A degradação desse material permite a liberação de nutrientes bioquimicamente disponíveis para mamíferos.[7]
No rúmen, os lipídios são fortemente alterados devido a dois processos principais: lipólise e biohidrogenação, respectivamente. Lipólise[8]: Os lipídios da alimentação são principalmente ésteres de ácidos graxos a álcoois (principalmente o glicerol), formando triglicerídeos, fosfolipídios e galactolipídios. Chegando ao rúmen sofrem a hidrólise (lipólise) ocorrendo no meio extracelular pela ação das bactérias ruminais e pouca influência também de protozoários ali presentes, fungos, fluidos digestivos e lipases das plantas. O glicerol e açúcares que são liberados pela hidrólise são fermentados a ácidos graxos de cadeia curta e alguns destes são utilizados por bactérias para a formação de fosfolipídios. Com a lipólise, são liberados no líquido ruminal ácidos graxos de cadeia longa, como o oleico, o linoléico e o linolênico.
Por sua vez, a biohidrogenação ocorre ao bactérias utilizarem ácidos graxos insaturados (principalmente os que contém 18 carbonos) para produzir um ácido graxo saturado e subsequente produção de energia.[9] Do metabolismo dos ácidos graxos insaturados no rúmen resulta como principal produto o ácido esteárico que passará ao abomaso e ao intestino, onde será absorvido. O processo normal da biohidrogenação dos ácidos oleico, linoleico e linolênico formará ácido esteárico, porém em algumas situações devido à incompleta biohidrogenação dos ácidos graxos ocorrem alterações que levam a formação final de ácidos graxos conjugados, como o ácido linoleico conjugado.[8]
O processo de biohidrogenação que acarreta na formação de ácido rumênico ocorre em etapas. A primeira é a isomerização do ácido linoleico em cLA por intermédio da enzima linoleato isomerase. O cLA pode ser absorvido pelo animal pela captação da glândula mamária e assim, transportado para o leite.[10] A etapa seguinte é a hidrogenação do carbono 9 e carbono 10, ou seja, conversão do c9,t11-cLA em trans-11 18:1 (ácido trans-vacênico). Este composto pode ser absorvido e nas glândulas mamárias serve como substrato para a síntese endógena do isômero cis-9, trans-11, pela ação da enzima Δ9-dessaturase. Estima-se que 78% do cLA presente na gordura do leite tem como origem a síntese endógena pela ação dessa enzima.
O cLA também pode ser sintetizado quimicamente, uma vez que os seus isômeros possuem possíveis efeitos positivos para a saúde humana. O cLA sintético contém quantidades aproximadamente idênticas dos isômeros c9,t11- e t10,c12-cLA (tipicamente 80-95% do cLA total), e outros isômeros minoritários, tais como isômeros trans,trans. Essa preparação é geralmente referida como uma mistura de cLA ou cLA 50:50, refletindo a presença desses dois isômeros majoritários.
Composição nos alimentos
As principais fontes naturais de cLA são alimentos de origem animal. Além disso, alguns produtos derivados de óleos de plantas contém cLA, porém em quantidades bem menores. Leite e derivados possuem quantidades maiores de cLA e o seu nível no produto final reflete a proporção de gordura láctea utilizada na preparação. Dentre os diferentes produtos cárneos, a carne de ruminantes mostra maior conteúdo de cLA. Já para frutos do mar e aves, exceto peru, pequenas quantidades foram reportadas.[11]
Na tabela abaixo, constam os isômeros do cLA mais relevantes que estão presentes nos laticínios.
| Nome IUPAC | Nome comum ou abreviado | Concentração aproximada em laticínios (% em cLA) |
|---|---|---|
| ácido (9Z,11E)-octadeca-9,11- dienóico | cis-9, trans-11 18:2 (ácido rumênico) | 85-90% |
| ácido (7E,9Z)-octadeca-7,9- dienóico | trans-7, cis-9 18:2 | 10% |
| ácido (10E, 12Z)-octadeca-10,12- dienóico | trans-10, cis-12 18:2 | 1% |
Fatores que podem influenciar
É conhecido que uma gama de fatores influencia o conteúdo de cLA no leite, tais como a alimentação do animal, a estação do ano, a raça do ruminante, o número de vezes que o animal já foi lactante e o estágio atual da lactação. Já foi demonstrado que um alto número de lactações leva à altas concentrações de gordura láctea[11]
Análise de cLA em alimentos
A análise de cLA nos alimentos inclui: separação, identificação e quantificação dos respectivos isômeros. A determinação de ácidos graxos requer o pré-tratamento da amostra para que os analitos sejam extraídos e convertidos a uma forma adequada para sua identificação e quantificação, de acordo com a técnica instrumental adotada[12].
A principal técnica empregada para determinar e quantificar os isômeros é a Cromatografia Gasosa acoplada a Espectrometria de Massa (CG/EM) ou com detecção por ionização de chama (CG/IC).[13]. Além disso, a cromatografia líquida de alta eficiência com íons de prata Ag+-CLAE tem sido utilizada com sucesso para a separação dos isômeros do cLA. Portanto, a CG ou a combinação de CG com Ag+-CLAE são métodos mais comumente adotados para a análise de cLA. [4].
Efeitos do cLA no organismo humano
Isômeros puros de cLA não estão disponíveis no mercado, mas sim uma mistura equimolar dos isômeros c9,t11- e t10,c12-cLA. Portanto, o foco principal de todos os estudos mecanísticos, pré-clínicos e clínicos pertencem aos isômeros majoritários – especialmente de misturas desses dois isômeros e os resultados conflitantes é de grande destaque.
A obesidade é considerada uma das causas de muitas doenças cardíacas, infertilidade e resistência à insulina. Nesse contexto, o cLA chama atenção, uma vez que estudos pré-clínicos em modelos animais provaram sua relação inversa com a obesidade.[14] Porém, estudos sobre os efeitos anti obesidade em humanos ainda permanecem escassos quando comparados aos de modelos animais. Um estudo mostrou que a ingestão do cLA pode contribuir no controle da obesidade e sobrepeso, uma vez que a produção de alguns biomarcadores pró inflamatórios relacionados à obesidade reduziu significativamente após a ingestão de uma manteiga enriquecida naturalmente com o ácido rumênico[15]. Além disso, outros estudos clínicos reportam correlações positivas entre a suplementação de cLA e melhoras no índice de massa corporal; peso corporal; massa de gordura corporal; adiposidade abdominal e massa magra corporal[16]
Observações anteriores implicam que a suplementação de cLA também pode ter efeitos no músculo esquelético (totaliza quase 40% da massa total de gordura), como por exemplo, o aumento da massa magra corporal, do gasto energético, do condicionamento físico e da β-oxidação dos ácidos graxos [16]
Já para a prevenção do câncer, a função do cLA é bem documentada. O cLA é um inibidor eficiente de todos os estágios da carcinogênese. Numerosos estudos, ambos in vitro e in vivo, demonstraram atividade anti cancerígena do cLA. O isômero t10,c12- cLA parece atuar preferencialmente através da modulação da apoptose e controle do ciclo celular.[17]
A maioria dos estudos clínicos com o cLA encontraram que ele não influencia os marcadores de lipídio no sangue para doenças cardiovasculares. Isso é mostrado consistentemente em publicações recentes, com a maioria reportando nenhuma alteração desses marcadores, mas poucas reportaram diminuições no colesterol total, LDL-c e/ou triglicerídeos depois do tratamento com cLA. É importante apontar que estudos prévios reportaram uma associação entre cLA e aumento da proteína C-reativa (PCR), embora publicações recentes reportaram nenhuma correlação entre CRP e cLA[16].
Nos últimos anos, a suplementação com cLA tem sido usada por atletas que desejam reduzir gordura corporal e possivelmente, melhorar a performance. Estudos em humanos demonstram que apenas o isômero t10,c12-cLA aumenta efetivamente a lipólise nos adipócitos, acompanhada da oxidação de ácidos graxos no músculo esquelético.[18]
Ainda há poucos relatos do cLA no que diz respeito a respostas imunológicas melhoradas em humanos.[19]
Efeitos adversos na saúde humana
Há estudos que indicam que o cLA sintético possui efeitos adversos na saúde humana. [20], tais como, desregulação da homeostase de glicose; aumento do estresse oxidativo; aumento da gordura hepática; depressão da gordura do leite; entre outros.
Os efeitos do cLA na homeostase da glicose não são consistentes em estudos com animais ou humanos. A maioria dos estudos não reportou associação dos níveis de glicose ou insulina com a suplementação de cLA[21][22][23].
Há estudos consistentes de que ambos os isômeros do cLA estão associados com o aumento de isoprostanos (marcadores do estresse oxidativo).[24].Baseado em observações de que o cLA é metabolizado à análogos estruturais de isoprostanos e de que não houve aumento significativo em outros marcadores oxidativos, tem sido sugerido que o cLA pode não representar um risco real de estresse oxidativo.[25].
Restrições
“O artigo 4º da RDC nº 332/2019 proíbe a produção, a importação, o uso e a oferta do CLA sintético para uso em alimentos e de alimentos formulados com estes ingredientes. Essa proibição se aplica ao CLA sintético destinado ao uso em alimentos e ingredientes, independentemente da origem ou finalidade de uso desses alimentos e ingredientes. [ ]... Por ser considerado um novo ingrediente, as empresas interessadas podem solicitar a avaliação pré-mercado de sua segurança de uso, por meio do protocolo da petição 4109, relativa à avaliação de segurança e eficácia de propriedades funcional ou de saúde de novos alimentos e novos Ingredientes, exceto probióticos e enzimas.”[20]
Ver Também
Referências
- ↑ Bruen, R., Fitzsimons, S., & Belton, O (2016). Atheroprotective effects of conjugated linoleic acid. British Journal of Clinical Pharmacology. 83 (1): 46–53. doi:10.1111/bcp.12948
- ↑ M.W. Pariza, L.J. Loretz, J.M. Storkson, N.C. Holland (1983). Mutagens and modulator of mutagenesis in fried ground beef. Cancer Res. 43 (5): 2444–2446. PMID: 6831468
- ↑ 3,0 3,1 A. Bernas, P. Laukkanen, N. Kumar, J. PaiviMaki-Arvela, E. Vayrynen, B. Laine, T. Holmbom, D.Y.M. Salmi (2002). A new heterogeneously catalytic pathway for isomerization of linoleic acid over Ru/C and Ni/H–MCM-41 catalysts, J. Catal. 210 (2): 354–366. doi:10.1006/jcat.2002.3690
- ↑ 4,0 4,1 Gong, M., Wei, W., Hu, Y., Jin, Q., & Wang, X (2020). Structure determination of conjugated linoleic and linolenic acids. Journal of Chromatography B, 1153: 1-12 doi:10.1016/j.jchromb.2020.122292
- ↑ M. Doreau, A. Meynadier, V. Fievez, A. Ferlay (2016). Handbook of Lipids in Human Function: Fatty Acids, in: R.R. Watson, F. de Meester (Eds.), Ruminal Metabolism of Fatty Acids: Modulation of Polyunsaturated, Conjugated, and Trans Fatty Acids in Meat and Milk, Academic Press and AOC Press: 521-542
- ↑ T.C. Jenkins, R.J. Wallace, P.J. Moate, E.E. Mosley (2008) Board-invited review: Recent advances in biohydrogenation of unsaturated fatty acids within the rumen microbial ecosystem, J. Anim. Sci, 86 (2): 397-412. PMID: 18042812
- ↑ S.A. Huws, M.B. Scott, J.K. Tweed, M.R Lee (2013). Fatty acid oxidation products ('green odour') released from perennial ryegrass following biotic and abiotic stress, potentially have antimicrobial properties against the rumen microbiota resulting in decreased biohydrogenation. J. Appl. Microbiol, 115 (5): 1081-1090. PMID: 23889811
- ↑ 8,0 8,1 [1]. Arquivado em Agosto de 2014. Acesso em 01/03/2021
- ↑ T.C. Jenkins, R.J. Wallace, P.J. Moate, E.E. Mosley (2008) Board-invited review: Recent advances in biohydrogenation of unsaturated fatty acids within the rumen microbial ecosystem. J. Anim. Sci, 86 (2): 397-412. PMID: 18042812
- ↑ J.M. Griinari, D.E. Bauman, M. P. Yurawecz, M. M. Mossoba, J. K.G. Kramer, M.W. Pariza, G. Nelson (1999). Biosynthesis of conjugated linoleic acid and its incorporation into meat and milk in ruminants, Advances in Conjugated Linoleic Acid Research, Champaign, IL: AOCS Press:180-200. doi:10.5713/ajas.2003.306
- ↑ 11,0 11,1 Gnädig, S., Xue, Y., Berdeaux, O., Chardigny, JM, & Sebedio, J.-L (2003). Conjugated linoleic acid (CLA) as a functional ingredient. Functional Dairy Products, 263–298. doi: 10.1533 / 9781855736917.2.263
- ↑ Gouvêa., M.M; Franco, C. F. J.; Marques, F. F. C.; Pereira Netto, A. D. «Ácidos Linoleicos Conjugados (ALC) – Os Benefícios que Exercem sobre a Saúde Humana e as Principais Metodologias Analíticas Aplicadas para a sua Determinação em Leites». Rev. Virtual Quim: http://rvq-sub.sbq.org.br/index.php/rvq/article/view/268
- ↑ Preuss, MB., Rohlfes, ALB., Baccar, NM., Marquardt, L., Oliveira, MSR., Schneider, RCS (2013). ÁCIDO LINOLEICO CONJUGADO: UMA BREVE REVISÃO. Revista Jovens Pesquisadores, Santa Cruz do Sul, 3 (2): 134-146. http://dx.doi.org/10.17058/rjp.v3i2.409
- ↑ Benjamin, S., Prakasan, P., Sreedharan, S., Wright, A.-DG, & Spener, F (2015). Pros and cons of CLA consumption: an insight from clinical evidences. Nutrition & Metabolism, 12 (1): 1-21. doi: 10.1186 / 1743-7075-12-4
- ↑ Penedo, LA, Nunes, JC, Gama, MAS, Leite, PEC, Quirico-Santos, TF, & Torres, AG (2013). Intake of butter naturally enriched with cis9,trans11 conjugated linoleic acid reduces systemic inflammatory mediators in healthy young adults. Journal of Nutritional Biochemistry, 24 (12), 2144-2151. doi: 10.1016/j.jnutbio.2013.08.006
- ↑ 16,0 16,1 16,2 Kim, JH, Kim, Y., Kim, YJ, & Park, Y (2016). Conjugated Linoleic Acid: Potential Health Benefits as a Functional Food Ingredient. Annu. Rev. Food Sci. Technol, 7 (1), 221–244. doi: 10.1146 / annurev-food-041715-033028
- ↑ Yang, B., Chen, H., Stanton, C., Ross, RP, Zhang, H., Chen, YQ, & Chen, W (2015). Review of the roles of conjugated linoleic acid in health and disease. Journal of Functional Foods, 15: 314–325. doi: 10.1016 / j.jff.2015.03.050
- ↑ Pariza MW, Park Y, Cook ME (2001). The biologically active isomers of conjugated linoleic acid. Prog Lipid Res, 40 (4):283–98. PMID: 11412893
- ↑ Bhattacharya A, Banu J, Rahman M, Causey J, Fernandes G (2006). Biological effects of conjugated linoleic acids in health and disease. J. Nutr. Biochem, 17 (12):789–810. PMID: 16650752
- ↑ 20,0 20,1 ANVISA. Resolução - RDC N 332. Arquivado em [[2]]. Acesso em 03/04/2021
- ↑ Dilzer, A., & Park, Y (2012). Implication of conjugated linoleic acid (CLA) in human health. Critical Reviews in Food Science and Nutrition, 52 (6), 488-513. doi: 10.1080 / 10408398.2010.501409
- ↑ Riserus U, Arner P, Brismar K, Vessby B (2002a). Treatment with dietary trans10cis12 conjugated linoleic acid causes isomer-specific insulin resistance in obese men with the metabolic syndrome. Diabetes Care, 25 (9): 1516–21. PMID: 12196420
- ↑ Riserus U, Vessby B, Arner P, Zethelius B. 2004a. Supplementation with trans10cis12-conjugated linoleic acid induces hyperproinsulinemia in obese men: close association with impaired insulin sensitivity. Diabetologia 47: 1016–19. PMID: 15168020
- ↑ Dilzer, A., & Park, Y (2012). Implication of conjugated linoleic acid (CLA) in human health. Critical Reviews in Food Science and Nutrition, 52 (6): 488-513. doi: 10.1080 / 10408398.2010.501409
- ↑ Banni S, Petroni A, Blasevich M, Carta G, Cordeddu L, et al. (2004). Conjugated linoleic acids (CLA) as precursors of a distinct family of PUFA. Lipids, 39 (11):1143–46. PMID: 15726830





 " class="attachment-atbs-s-4_3 size-atbs-s-4_3 wp-post-image" alt="O que estudar para o enem 2023">
" class="attachment-atbs-s-4_3 size-atbs-s-4_3 wp-post-image" alt="O que estudar para o enem 2023"> " class="attachment-atbs-s-4_3 size-atbs-s-4_3 wp-post-image" alt="Qual melhor curso para fazer em 2023">
" class="attachment-atbs-s-4_3 size-atbs-s-4_3 wp-post-image" alt="Qual melhor curso para fazer em 2023"> " class="attachment-atbs-s-4_3 size-atbs-s-4_3 wp-post-image" alt="Enem: Conteúdos E Aulas On-Line São Opção Para Os Estudantes">
" class="attachment-atbs-s-4_3 size-atbs-s-4_3 wp-post-image" alt="Enem: Conteúdos E Aulas On-Line São Opção Para Os Estudantes"> " class="attachment-atbs-s-4_3 size-atbs-s-4_3 wp-post-image" alt="Como Fazer Uma Carta De Apresentação">
" class="attachment-atbs-s-4_3 size-atbs-s-4_3 wp-post-image" alt="Como Fazer Uma Carta De Apresentação"> " class="attachment-atbs-s-4_3 size-atbs-s-4_3 wp-post-image" alt="Como Escrever Uma Boa Redação">
" class="attachment-atbs-s-4_3 size-atbs-s-4_3 wp-post-image" alt="Como Escrever Uma Boa Redação"> " class="attachment-atbs-s-4_3 size-atbs-s-4_3 wp-post-image" alt="Concurso INSS edital 2022 publicado">
" class="attachment-atbs-s-4_3 size-atbs-s-4_3 wp-post-image" alt="Concurso INSS edital 2022 publicado">


