Este artigo não cita fontes confiáveis. (Junho de 2022) |
| style="background: #Predefinição:Chembox fundo; text-align: center;" colspan="2" | Ácido láctico Alerta sobre risco à saúde | |
|---|---|
|

|
| Nome IUPAC | ácido 2-hidróxipropanóico |
| style="background: #Predefinição:Chembox fundo; text-align: center;" colspan="2" | Propriedades | |
| Fórmula molecular | C3H6O3 |
| Massa molar | 90.08 g/mol |
| Ponto de fusão |
L: 28 °C |
| Ponto de ebulição |
122 °C @ 12 mmHg |
| Acidez (pKa) | 3.85 |
| style="background: #Predefinição:Chembox fundo; text-align: center;" colspan="2" | Compostos relacionados | |
| hidroxiácidos relacionados | Ácido glicólico (hidroxietanoico) Ácido 3-hidroxipropiônico (isômero) Ácido glicérico (2,3-diidroxipropanoico) Ácido alfa-hidroxibutírico Ácido málico (hidroxibutanodioico) Ácido cítrico |
| Compostos relacionados | Ácido propanóico Álcool isopropílico Propilenoglicol Ácido pirúvico (hidroxila no C2 oxidada para carbonila) Alanina (aminoácido) Lactida (diéster cíclico) |
| style="background: #Predefinição:Chembox fundo; text-align: center;" colspan="2" | Página de dados suplementares | |
| Estrutura e propriedades | n, εr, etc. |
| Dados termodinâmicos | Phase behaviour Solid, liquid, gas |
| Dados espectrais | UV, IV, RMN, EM |
| style="background: #Predefinição:Chembox fundo; text-align: center;" colspan="2" | Exceto onde denotado, os dados referem-se a materiais sob condições normais de temperatura e pressão Referências e avisos gerais sobre esta caixa. Alerta sobre risco à saúde. |
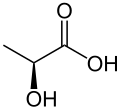
O ácido láctico ou lático (do latim lac, lactis, leite), é um composto orgânico de função mista ácido carboxílico - álcool que apresenta fórmula molecular C3H6O3 e estrutural CH3 - CH ( OH ) - COOH. Participa de vários processos bioquímicos, e o lactato é a forma ionizada deste ácido. Foi descoberto pelo químico sueco Carl Wilhelm Scheele, no leite coalhado.
Pela nomenclatura IUPAC é conhecido como ácido 2-hidroxipropanóico ou ácido α-hidroxipropanóico.
O lactato proporciona uma valiosa fonte de energia química que se acumula como resultado de exercícios físicos intensos, quando a respiração aeróbia não da conta da demanda para geração de energia. Normalmente, o organismo degrada a glicose presente no nosso corpo juntamente com o oxigênio proveniente da respiração, produzindo energia. Entretanto, se o esforço desempenhado pela pessoa está acima da sua condição física,o organismo começa a quebrar glicose sozinha e produzir ácido lático. Quando essa molécula se encontra em excesso nos músculos (na qual ela é muito mais formada do que eliminada) causa cansaço e dores musculares.
Propriedades
O ácido láctico apresenta isomeria óptica:
- Dextrógiro: d-ácido lático
- Levógiro: ℓ-ácido lático
- Racêmico: d,ℓ-ácido lático
Físicas
- Os isômeros d e ℓ desviam o plano de vibração da luz polarizada.
- Densidade = 1,206 g/mL
- Ponto de fusão: O racêmico funde a 18 °C e os d e ℓ fundem a 28 °C.
- Ponto de ebulição: O racêmico entra em ebulição a 122 °C.
Obtenção
Fermentação láctica
- A partir do açúcar do leite (lactose) com o Bacillus lactis acidi.
- A partir do amido, açúcar da uva (glicose) ou açúcar da cana (sacarose) utilizando o Bacillus Delbrücki.
- A partir do melaço, geralmente utilizando bactérias do gênero Lactobacillus sp.
A obtenção de ácido lático com enzimas ou micro-organismos vivos pode produzir os isômeros destrógiro ou levógiro, dependendo da enzima envolvida no processo.
Agentes
As bactérias láticas são os microrganismos utilizados na produção dessa moléculas e podem ser classificadas em dois tipos a partir do produto formado: Homofermentativas e Heterofermentativas.
Além do mais, possuem características marcantes como sendo Gram-positivas, não sintetizam ATP por vias respiratórias (microaerofílicas), são incapazes de sintetizar hemeproteínas, não esporulam e apresentam colônias pequenas e apigmentadas.
Homofermentativas
Classificada assim por produzir somente ácido lático, sendo os primeiros estágios da via metabólica da fermentação lática os mesmo da fermentação alcoólica. Forma o ácido pirúvico como intermediário e rende 2 moles de ATP (adenosina trifosfato) por cada mol de glicose.
Heterofermentativas
A fermentação da glicose resulta em vários produtos (como ácido lático, oxalacético e fórmico), degradando o açúcar pela via oxidativa das pentoses fosfato. Forma o ácido pirúvico e o aldeído acético como intermediários e produz 1 ATP por mol de glicose.
Reação química em laboratório
Reagindo o etanal com uma mistura de cianeto de sódio e ácido sulfúrico:
- CH3 - COH + HCN ( NaCN + H2SO4 ) → CH3 - CH ( OH ) - COOH
A obtenção que não envolve enzimas produz, geralmente, o ácido lático racêmico.
Ocorrência
É encontrado no suco de carne, leite azedo, nos músculos e em alguns órgãos de algumas plantas ou animais.
Aplicações e usos
- Alimentação de crianças, como Yakult.
- Como purgante, na forma de lactobacilos de cálcio ou lactato de magnésio.
- Removedor de sais de cálcio.
- Como mordente.
- Curtimento de peles.
- Matéria-prima em sínteses orgânicas.
- Como monômero do poliácido láctico.
- Fabricação de polímeros (biodegradáveis, termoplásticos e transparentes).
- Acidulante em produtos alimentícios.
- Na forma de lactato, muito utilizado na indústria farmacêutica e de cosméticos,.




 " class="attachment-atbs-s-4_3 size-atbs-s-4_3 wp-post-image" alt="O que estudar para o enem 2023">
" class="attachment-atbs-s-4_3 size-atbs-s-4_3 wp-post-image" alt="O que estudar para o enem 2023"> " class="attachment-atbs-s-4_3 size-atbs-s-4_3 wp-post-image" alt="Qual melhor curso para fazer em 2023">
" class="attachment-atbs-s-4_3 size-atbs-s-4_3 wp-post-image" alt="Qual melhor curso para fazer em 2023"> " class="attachment-atbs-s-4_3 size-atbs-s-4_3 wp-post-image" alt="Enem: Conteúdos E Aulas On-Line São Opção Para Os Estudantes">
" class="attachment-atbs-s-4_3 size-atbs-s-4_3 wp-post-image" alt="Enem: Conteúdos E Aulas On-Line São Opção Para Os Estudantes"> " class="attachment-atbs-s-4_3 size-atbs-s-4_3 wp-post-image" alt="Como Fazer Uma Carta De Apresentação">
" class="attachment-atbs-s-4_3 size-atbs-s-4_3 wp-post-image" alt="Como Fazer Uma Carta De Apresentação"> " class="attachment-atbs-s-4_3 size-atbs-s-4_3 wp-post-image" alt="Como Escrever Uma Boa Redação">
" class="attachment-atbs-s-4_3 size-atbs-s-4_3 wp-post-image" alt="Como Escrever Uma Boa Redação"> " class="attachment-atbs-s-4_3 size-atbs-s-4_3 wp-post-image" alt="Concurso INSS edital 2022 publicado">
" class="attachment-atbs-s-4_3 size-atbs-s-4_3 wp-post-image" alt="Concurso INSS edital 2022 publicado">


