Predefinição:Chembox new Tribrometo de fósforo é um composto químico que se apresenta a temperatura ambiente como um líquido incolor com a fórmula PBr3. Produz fumos ao ar devido a sua hidrólise e tem um odor penetrante. É largamente usado em laboratório, em síntese orgânica para a conversão de álcoois e brometos de alquila.
Propriedades químicas
Tribrometo de fósforo, como PCl3 e PF3, tem tanto propriedades de uma base de Lewis como de um ácido de Lewis. Por exemplo, com um ácido de Lewis tal como tribrometo de boro ele forma adutos estáveis 1:1 tais como Br3B-PBr3. Ao mesmo tempo PBr3 pode reagir como um eletrófilo ou ácido de Lewis em muitas de suas reações, por exemplo com suas aminas.
A mais importante reação do PBr3 é com álcoois, onde substitui um grupo OH com um átomo de bromo para produzir um brometo de alquila. Note-se que todos os três átomos de bromo podem ser transferidos.
- PBr3 + 3 ROH → 3 RBr + HP(O)(OH)2
O mecanismo (mostrado para um álcool primário) envolve ativação inicial do oxigênio do álcool pelo fósforo eletrofílico (para formar um bom grupo lábil), seguida por uma substituição SN2 no carbono do álcool.
Por causa de uma etapa da substituição SN2, a reação geralmente trabalha bem para álcoois primários e secundários, mas falha para álcool terciários. Se o carbono central reagente é quiral, a reação normalmente ocorre com inversão de configuração no álcool carbono alfa, como é usual com uma reação SN2.
Em uma reação cimilar, PBr3 também converte ácidos carboxílicos a brometos de acila.
- PBr3 + 3 RCOOH → 3 RCOBr + HP(O)(OH)2
PBr3 é um agente redutor razoavelmente forte, e a oxidação de PBr3 com gás oxigênio é mais vigorosa que a vista com PCl3. Ele resulta em uma reação explosiva que forma P2O5 e Br2.
Preparação
PBr3 é preparado pelo tratamento de fósforo com bromo, usando o próprio PBr3 como solvente (fósforo branco é solúvel em PBr3). Um excesso de fósforo é usado de maneira a prevenir a formação de PBr5.
Usos
O principal uso para tribrometo de fósforo é para a conversão de álcoois primários ou secundários a brometo de alquila,[1] como descrito acima. PBr3 usualmente dá mais altos rendimentos que ácido bromídrico, e evitando problemas de rearranjo de carbocátion - por exemplo quando brometo de neopentil pode ser feito do álcool a 60% de rendimento.[2]
Outro uso para o PBr3 é como catalisador para a α-brominação de ácidos carboxílicos. Embora brometos de acila são raramente comparados com cloretos de acila, eles são usados como intermediários na halogenação de Hell-Volhard-Zelinsky.[3] Inicialmente PBr3 reage com o ácido carboxílico para formar brometo de acila, a qual é mais reativa para prominação. O processo como um todo pode ser representado como
Em escala comercial, tribrometo de fósforo é usado na fabricação de fármacos tais como alprazolam, methohexital e fenoprofen. É também um potente agente supressor de fogo comercializado sob o nome PhostrEx [1].
Precauções
O PBr3 é tóxico e reage violentamente com a água e com álcoois. Suas reações envolvem HBr, que é corrosivo.
Em reações que produzem ácido fosforoso como subproduto, deve-se tomar cuidado ao trabalhar com destilação, pois a fosfina é produzida pela decomposição deste subproduto a 160 °C, o que pode provocar explosões em contato com o ar.[4]
Referências
- ↑ N. N. Greenwood, A. Earnshaw, Chemistry of the Elements, 2nd ed., Butterworth-Heinemann, Oxford, UK, 1997.
- ↑ Handbook of Chemistry and Physics, 71st edition, CRC Press, Ann Arbor, Michigan, 1990.
- ↑ J. March, Advanced Organic Chemistry, 4th ed., p. 723, Wiley, New York, 1992.
- ↑ Harrison, G. C.; Diehl, H. (1955). "β-Ethoxyethyl Bromide". Org. Synth.; Coll. Vol. 3, p. 370





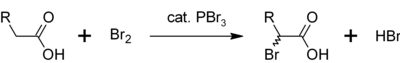
 " class="attachment-atbs-s-4_3 size-atbs-s-4_3 wp-post-image" alt="O que estudar para o enem 2023">
" class="attachment-atbs-s-4_3 size-atbs-s-4_3 wp-post-image" alt="O que estudar para o enem 2023"> " class="attachment-atbs-s-4_3 size-atbs-s-4_3 wp-post-image" alt="Qual melhor curso para fazer em 2023">
" class="attachment-atbs-s-4_3 size-atbs-s-4_3 wp-post-image" alt="Qual melhor curso para fazer em 2023"> " class="attachment-atbs-s-4_3 size-atbs-s-4_3 wp-post-image" alt="Enem: Conteúdos E Aulas On-Line São Opção Para Os Estudantes">
" class="attachment-atbs-s-4_3 size-atbs-s-4_3 wp-post-image" alt="Enem: Conteúdos E Aulas On-Line São Opção Para Os Estudantes"> " class="attachment-atbs-s-4_3 size-atbs-s-4_3 wp-post-image" alt="Como Fazer Uma Carta De Apresentação">
" class="attachment-atbs-s-4_3 size-atbs-s-4_3 wp-post-image" alt="Como Fazer Uma Carta De Apresentação"> " class="attachment-atbs-s-4_3 size-atbs-s-4_3 wp-post-image" alt="Como Escrever Uma Boa Redação">
" class="attachment-atbs-s-4_3 size-atbs-s-4_3 wp-post-image" alt="Como Escrever Uma Boa Redação"> " class="attachment-atbs-s-4_3 size-atbs-s-4_3 wp-post-image" alt="Concurso INSS edital 2022 publicado">
" class="attachment-atbs-s-4_3 size-atbs-s-4_3 wp-post-image" alt="Concurso INSS edital 2022 publicado">


