| Leishmaniose | |
|---|---|
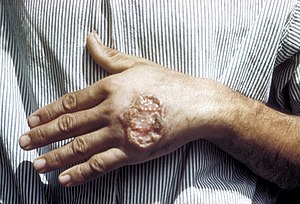
| Úlcera de leishmaniose cutânea na mão de um adulto. | |
| Sinónimos | Leishmaníase |
| Especialidade | Infectologia |
| Sintomas | Úlceras na pele, febre, diminuição dos glóbulos vermelhos, aumento de volume do fígado[1][2] |
| Tipos | Leishmaniose cutânea, leishmaniose mucocutânea, leishmaniose visceral[1] |
| Causas | Parasitas Leishmania transmitidos sobretudo por flebotomíneos[1] |
| Prevenção | Redes mosquiteiras, insecticida[1] |
| Frequência | 4–12 milhões[3][4] |
| Mortes | 24 200 (2015)[5] |
| Classificação e recursos externos | |
| CID-10 | B55 |
| CID-9 | 085 |
| DiseasesDB | 3266 29171 3266 7070 |
| MedlinePlus | 001386 |
| eMedicine | emerg/296 |
Leishmaniose é uma doença infecciosa causada por protozoários parasitários do género Leishmania transmitidos pela picada de insetos da subfamília dos flebotomíneos.[6][1] Existem três tipos principais: leishmaniose cutânea, leishmaniose mucocutânea e leishmaniose visceral.[1] O sintoma mais evidente da forma cutânea são úlceras na pele. Na forma mucocutânea, as úlceras afetam não só a pele como também a boca e nariz. O sintoma inicial da forma visceral são úlceras na pele, a que mais tarde acresce febre, diminuição do número de glóbulos vermelhos e aumento de volume do baço e fígado.[1][2]
As infeções em seres humanos são causadas por mais de 20 espécies de Leishmania.[1] O parasita é transmitido pela picada de mosquitos fêmea de algumas espécies de flebotomínios. No Velho Mundo, o vetor mais comum são espécies do género Phlebotomus, enquanto no Novo Mundo é transmitida exclusivamente por espécies do género Lutzomyia.[7] Entre os fatores de risco estão a pobreza, a desnutrição, desmatamento e urbanização.[1] Os três tipos podem ser diagnosticados mediante observação do parasita ao microscópio óptico.[1] O diagnóstico da forma visceral pode ser feito por meio de análises ao sangue.[2]
A leishmaniose pode ser em parte prevenida dormindo protegido por redes mosquiteiras tratadas com insecticida.[1] Entre outras medidas estão o uso de insecticida para matar o mosquito-palha e tratar imediatamente as pessoas infectadas para evitar que transmitam a doença.[1] O tratamento depende do local onde foi adquirida a doença, da espécie de Leishmania e do tipo de infeção.[1] Entre os medicamentos usados para tratar a leishmaniose visceral estão a anfotericina B lipossómica,[8] a associação de antimónio pentavalente e paromomicina,[8] e a miltefosina.[9] Entre os medicamentos usados no tratamento das formas cutâneas estão a paromomicina, fluconazol e a pentamidina.[10]
Estima-se que atualmente estejam infetadas com a doença entre 4 e 12 milhões de pessoas[3][4] em 98 países.[2] Todos os anos ocorrem dois milhões de novos casos[2] e entre 20 a 50 mil mortes.[1][11] Cerca de 200 milhões de pessoas vivem em regiões da Ásia, África, América Central e do Sul e Europa do Sul onde a doença é comum.[2][12] A Organização Mundial de Saúde fornece medicamentos para o tratamento da doença a custo reduzido.[2] A leishmaniose está classificada como doença tropical negligenciada.[13] A doença pode também ocorrer numa série de outros animais, incluindo cães e roedores.[1]
Sinais, sintomas e classificação
As manifestações clínicas da doença dependem diretamente do sistema imune do hospedeiro e da espécie do parasito. De acordo com esses fatores, pacientes infectados podem passar anos sem apresentar sinais e sintomas ou desenvolver variações mais graves das doenças. A leishmaniose cutânea, além de causar feridas dérmicas, pode evoluir para as formas de Leishmaniose Cutânea Difusa, com presença de múltiplos nódulos ulcerados ou não, e a forma Mucocutânea, que causa lesões nas mucosas das vias aéreas superiores, podendo causar desfiguração.[14]
A infecção por HIV representa um fator de risco para a infecção por Leishmania, sendo casos de coinfecções HIV-Leishmania bastante comuns, principalmente para a forma visceral. Assim como nos pacientes com imunocomprometimento causados por desnutrição ou imunossupressivos quimioterápicos, as coinfecções com HIV podem resultar em complicações mais severas e manifestações atípicas da doença, o que pode retardar o diagnóstico e dificultar o tratamento. Nesses casos, independentemente do tratamento utilizado, a eliminação completa do parasito dificilmente ocorre, resultando em relapsos após períodos oligossintomáticos e assintomáticos.[15][16]
A vulnerabilidade e as complicações em pacientes imunocomprometidos são explicadas pela baixa contagem de linfócitos TCD4+.[17] Os linfócitos auxiliares Th1 são os principais responsáveis pelo controle parasitário e a proteção imune relacionado a Leishmania. Essas células produzem citocinas pró inflamatórias (TNF-α, Interleucina 12 e IFN-γ) e ativam os macrófagos, tornando-os capazes de eliminar os parasitos.[18]
Leishmaniose visceral
A leishmaniose visceral (LV), também conhecida como calazar, barriga d’água e febre dundun, é a forma mais severa de leishmaniose. É a terceira parasitose mais letal, depois da malária e da amebíase. Estima-se que cause entre 20.000 e 40.000 mortes por ano no mundo.[19] O parasita migra para os órgãos viscerais como fígado, baço, linfonodos e medula óssea e, caso se desenvolva a doença e não sendo feito tratamento adequado, quase sempre resultará na morte do hospedeiro. Sinais e sintomas incluem:[20]
- Febre prolongada
- Úlceras escuras na pele
- Aumento do baço (esplenomegalia)
- Aumento do fígado (hepatomegalia)
- Leucopenia
- Anemia
- Hipergamaglobulinemia
- Tosse
- Dor abdominal
- Diarreia
- Perda de peso
- Caquexia
Outros sintomas possíveis são tremores violentos, diarreia, suores, mal estar e fadiga. Se não tratada, pode ser fatal num período curto ou após danos crônicos durante alguns anos. O diagnóstico certo é difícil, pois vários desses sintomas também são encontrados na doença de Chagas, malária, esquistossomose, febre tifoide e tuberculose, doenças comuns nas áreas endêmicas da Leishmaniose visceral.[20]
Meses ou até anos (geralmente 2-7 anos) após o tratamento da leishmaniose visceral e sua aparente cura, pode surgir uma forma secundária da doença chamada Leishmaniose dérmica pós-calazar ou LDPC. Esta condição se manifesta primeiro como lesões de pele na face que gradualmente aumentam em tamanho e espalham-se pelo corpo. Eventualmente as lesões podem ser desfigurantes, deixando cicatrizes semelhantes a lepra e causando cegueira ocasionalmente se atingirem as córneas. Esta forma é principalmente observada em pacientes infetados com L. donovani no leste da África e subcontinente Indiano.[21]
Leishmaniose cutânea

Leishmaniose cutânea, também conhecida como ferida brava, úlcera de Bauru, botão do Oriente e outras denominações menos populares, é a forma mais comum de leishmaniose. Tem como característica a presença de feridas indolores no local da picada do vetor, as feridas comumente são arredondadas ou ovaladas, com as bordas elevadas e bem delimitadas, fundo eritematoso, com consistência firme, granuloso e avermelhado. Após a inoculação do parasita, é possível que meses ou até anos se passem até a manifestação da doença.[carece de fontes]
Dificilmente a forma cutânea leva à morte do paciente, e em muitos casos as feridas podem sarar espontaneamente, deixando ou não cicatrizes. Entretanto é possível que haja complicações da doença, como infecções secundárias das úlceras por bactérias ou evolução para formas mais graves do doença, como a forma mucocutânea.[22]
Há aproximadamente 20 espécies de Leishmania que podem causar leishmanioses cutâneas.[carece de fontes]
Leishmaniose mucocutânea
A leishmaniose mucocutânea é a mais temida forma de leishmaniose cutânea porque produz lesões destrutivas das mucosas e cartilagens, assim desfigurando a face. É causada frequentemente por Leishmania (Viannia) braziliensis e outras espécies do subgênero Viannia, mas são descritos raramente casos provocados por Leishmania (Leishmania) aethiopica.[carece de fontes]
Epidemiologia
De acordo com a Organização Mundial da Saúde, mais de 1 bilhão de pessoas estão sob risco de contrair a doença nos 89 países onde ela ocorre.[23]
Acredita-se que os casos de leishmaniose são subdiagnosticados e subnotificados em todo o globo devido principalmente aos casos subclínicos (assintomáticos ou oligossintomáticos) e a sua relação com populações mais pobres, onde a infraestrutura para diagnóstico e o acesso a agentes de saúde são precários e escassos. Esses fatores, juntamente com os casos que aparecem em hospitais privados ou não governamentais, dificultam a obtenção de números precisos sobre a incidência das leishmanioses.[17][12]
A forma mais comum de leishmaniose é a cutânea, acometendo entre 700 mil e 1,2 milhão de pessoas no mundo. A Leishmaniose Cutânea ocorre no Novo Mundo desde o sul do Texas, até a América do Sul, com exceção de Chile e Uruguai, porém os casos se concentram principalmente na bacia Amazônica e outras áreas de floresta úmida das Américas do Sul e Central. Já no Velho mundo, ocorre na bacia do Mediterrâneo, Oriente Médio, Ásia e África Central.[24] Mais de 70% dos casos ocorrem em 10 países: Afeganistão, Argélia, Brasil, Colômbia, Costa Rica, Etiópia, Irã, Peru, Síria e Sudão. Nos 12 países considerados de alta incidência de Leishmaniose Cutânea, 399 milhões de pessoas correm risco de contrair a doença.[23]
A forma visceral acomete entre 200 mil e 400 mil pessoas por ano e é responsável por causar entre 20.000 e 40.000 mortes. Estima-se que 90% dos casos de Leishmaniose Visceral ocorram em 6 países: Bangladesh, Brasil, Etiópia, Índia, Sudão e Sudão do Sul, havendo em torno de 556 milhões de pessoas em risco nos 14 países considerados de alta incidência pela OMS.[23]
No Velho Mundo, a Leishmaniose Visceral ocorre na bacia do mediterrâneo, China central, Índia, Oriente Médio e no Chifre da África. No Novo Mundo ocorre principalmente na costa do nordeste brasileiro, com focos esporádicos distribuídos pelo resto da América do Sul e Central.[24]
A Leishmaniose dérmica pós-calazar ocorre principalmente no leste africano, onde cerca de 50-60% dos casos de LV devidamente tratados evoluem para LDPC em pacientes sudaneses. No subcontinente indiano ocorre após cerca de 10-20% dos casos de LV.[21]
O Brasil possui uma média anual de 26.965 casos de Leishmaniose Cutânea, com média de 15,7 casos a cada 100.000 habitantes.[25] Para a LV, o Brasil concentra mais de 90% dos casos das Américas, sendo a média anual de casos de 3.418, com média de 1,8 casos a cada 100.000 habitantes.[26] O Brasil é o único país com alta incidência tanto de leishmaniose cutânea, quanto de leishmaniose visceral.[23] Tanto para Leishmaniose Cutânea, quanto para a Leishmaniose Visceral houve uma expansão da distribuição geográfica e aumento no número de casos nas últimas décadas.[27][26][25][28]
A transmissão da leishmaniose pode ocorrer em ciclos zoonóticos, antroponóticos ou antropozoonóticos. No Novo Mundo, a LC recebe o nome de Leishmaniose Tegumentar Americana (LTA) e está ligada aos ciclos silvestres e zoonóticos da doença. Preguiças, roedores, marsupiais e canídeos silvestres são incriminados como os principais reservatórias. Animais sinantrópicos (roedores) e domésticos (cães, gatos, equinos) também são acometidos pela doença, mas seu papel na manutenção dos parasitos como reservatório ainda é incerta.[22] Ainda no Novo Mundo, a Leishmaniose Visceral é causada por Leishmania (Leishmania) infantum e vem expandindo suas áreas de ocorrência e se aproximando cada vez mais de centros urbanos, sendo os cães domésticos os principais reservatórios.[27]
No velho mundo, a principal espécie causadora de LV é Leishmania (Leishmania) donovani e as transmissões ocorrem principalmente em áreas peridomiciliares e em ciclos antroponóticos. Os ciclos da LC são tanto antroponóticos, nas regiões de ocorrência de Leishmania (Leishmania) tropica, quanto antropozoonóticos, com L. (L) major e L. (L) aethiopica como as principais espécies.[29]
A ocorrência das leishmanioses tem aumentado globalmente nas últimas décadas e diversos fatores estão relacionados com a incidência, distribuição e o seu recente aumento.[28]
A pobreza se destaca como um fator determinante no risco destas infecções. Condições precárias de moradia e sanitárias, como ausência de gestão de resíduos e saneamento, atraem e favorecem a procriação dos flebotomíneos. A falta de escolaridade e acesso a serviços médicos, má nutrição e constante exposição aos vetores nos ambientes de residência e trabalho também aumentam os riscos de contrair essa doença. Por essas razões, a leishmaniose e a pobreza acabam compondo um ciclo vicioso. A doença causa morbidade prolongada, estigma social, evasão escolar, dificuldades no trabalho e até mesmo a morte, no caso da LV. Em crianças pode prejudicar o desenvolvimento cognitivo e a educação, fatores que contribuem para o empobrecimento e, consequentemente, a maior exposição à doença.[30][31]
O desmatamento também é apontado como um fator relacionado às leishmanioses. A substituição das florestas por plantações ou moradias levam as pessoas a habitarem locais próximos ao ambiente natural dos flebotomíneos e reservatórios. Cães e outros animais domésticos atraem os vetores para perto das residências e o ciclo da doença torna-se periurbano ou doméstico.[32]
O aumento dos casos de leishmaniose e a expansão da doença para áreas não endêmicas possuem relação com a globalização, o aquecimento global e guerras e conflitos. O aquecimento global permite a expansão da área de ocorrência dos vetores, possibilitando a presença da doença em áreas antes não endêmicas. Também houve um aumento do número de casos em viajantes voltando de regiões tropicais e subtropicais, seja por viagens internacionais a turismo ou excursões militares.[32][15][33] Há estudos que demonstram que migrantes e turistas possuem maior risco de desenvolver a doença que a população local. Nesses casos de importação da doença para fora de áreas endêmicas, os diagnósticos costumam ser atrasados, pois a falta de contato com a doença leva a baixa suspeita de leishmaniose.[32]
Guerras, conflitos, migrantes e refugiados também estão correlacionados com a incidência de leishmaniose. Na Síria, a guerra causou o colapso da infraestrutura de saúde do país, desabrigou grande parte da população e causou a concentração de milhares de refugiados em situações precárias de moradia e higiene. As migrações para áreas endêmicas causam a exposição da população, por outro lado a migração para áreas não endêmicas pode introduzir a doença em novos locais. Entre 2004 e 2008, a incidência de LC na Síria foi estimada em 23.000 casos por ano, tendo mais do que dobrado poucos anos depois. Em 2012, 53.000 casos foram reportados, e na primeira metade de 2013, 41.000 casos. Além disso, acredita-se que grande parte dos casos não são reportados, sendo assim a real incidência pode ser ainda maior. Países como a Turquia, Líbano e outros que receberam grande quantidade de refugiados sírios também apresentaram aumento dos casos de leishmaniose cutânea.[29][33]
Causas
Organismos

A Leishmania é um protozoário parasita de células do sistema fagocítico mononuclear de mamíferos e répteis, especialmente de macrófagos. As formas promastigotas (infecciosas) são alongadas e possuem um flagelo locomotor anterior, que utilizam nas fases extracelulares do seu ciclo de vida. O amastigota (intracelular) possui um flagelo rudimentar.[carece de fontes]
Há cerca de 30 espécies patogênicas para o ser humano (CDC). As mais importantes são:[carece de fontes]
- As espécies L. donovani, L. infantum infantum, e L. infantum chagasi que podem produzir a leishmaniose visceral, mas, em casos leves, apenas manifestações cutâneas.
- As espécies L. major, L. tropica, L. aethiopica, L. mexicana, L. braziliensis, L. amazonensis e L. peruviana que produzem a leishmaniose cutânea ou, no caso de L. braziliensis e L. peruviana, a mais grave, mucocutânea.
- Leishmaniose principalmente visceral (organismos mais agressivos):
- L. donovani é a mais frequente causa de leishmaniose visceral. Em algumas regiões (Índia Paquistão, Bangladesh e Sudão) encontra-se uma forma de leishmaniose dérmica pos-calazar (LPDC). É transmitida por Phlebotomus e existe no subcontinente indiano e na África equatorial (desconhecida em Angola e Moçambique). O reservatório são os seres humanos, sendo os cães infetados no Sudão e possíveis reservatórios.
- L. infantum infantum provoca uma variante menos grave da leishmaniose visceral e existe na região mediterrânica, incluindo países do Norte de África, Turquia, Israel, Grécia, Itália, sul da França, Portugal e Espanha e ainda nos Balcãs, Irão, algumas regiões da China e Ásia central. É transmitida por Phlebotomus e o seu reservatório são os cães, lobos e raposas. Em Portugal é mais frequente em regiões como Trás-os-Montes, Coimbra e a Beira Litoral, Algarve e na região dos estuários dos rios Sado e Tejo.
- L. infantum chagasi existe na América Latina, incluindo Brasil. O inseto transmissor é o flebotomíneo Lutzomyia. Reservatórios: cães e gambás. Esta espécie é considerada uma subespécie de L. infantum.
- L. donovani é a mais frequente causa de leishmaniose visceral. Em algumas regiões (Índia Paquistão, Bangladesh e Sudão) encontra-se uma forma de leishmaniose dérmica pos-calazar (LPDC). É transmitida por Phlebotomus e existe no subcontinente indiano e na África equatorial (desconhecida em Angola e Moçambique). O reservatório são os seres humanos, sendo os cães infetados no Sudão e possíveis reservatórios.
- Leishmaniose principalmente cutânea (organismos de virulência baixa):
- L. major: Norte de África, Médio Oriente e Ásia Central. Transmitida por Phlebotomus, principalmente P. papatasi. Reservatório: roedores. Responsável por produzir ulcerações úmidas, de evolução rápida.
- L. aethiopica: Existe na Etiópia e no Quénia. Transmitida por Phlebotomus. Reservatório: Hyrax, espécies de pequenos mamíferos.
- L. tropica: Existe em países da costa Sul e Leste do Mediterrâneo e no Médio Oriente. Transmitida por Phlebotomus. O reservatório é principalmente humano (antroponose), mas o Hyrax também foi incriminado em alguns foci.
- L. mexicana: encontra-se no México, na Guatemala e Belize. Transmissão por espécies do género Lutzomyia. O reservatório são roedores e marsupiais. Gera úlceras benignas na pele.
- L. amazonensis: América do Sul. Transmissão por espécies do género Lutzomyia. O reservatório são os roedores. Produz lesões cutâneas, às vezes múltiplas.
- Leishmaniose principalmente mucocutânea (virulência intermédia):
- L. braziliensis: existe em todo o Brasil, Venezuela, Colômbia e Guianas. Transmissão por espécies do género Lutzomyia. Reservatório: roedores e gambás. Caracteriza-se por formar úlceras cutâneas (raramente múltiplas), expansivas e persistentes, frequentemente acompanhadas de lesões graves da nasofaringe.
- L. peruviana: predomina nos países andinos, Bolívia, Peru, Equador, Colômbia e Venezuela. Reservatório: cães.
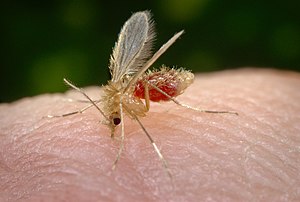
Vetores
Os parasitos causadores das leishmanioses são transmitidos pela picada das fêmeas de insetos dípteros da subfamília Phlebotominae (Diptera:Psychodidae).[carece de fontes]
Os flebotomíneos são cruciais na transmissão da leishmaniose, que ocorre quando os insetos se alimentam de humanos ou animais infectados. A seguir, o crescimento dos flagelados no tubo digestivo do vetor torna-se suficiente para assegurar sua inoculação em hospedeiros susceptíveis.[carece de fontes]
Se, pouco depois de infectar-se, o flebotomíneo volta a alimentar-se com sangue, o crescimento dos flagelados pode ser inibido. Mas se a segunda refeição for feita com sucos de plantas (ou, nas condições de laboratório, com passas ou soluções açucaradas), as formas promastigotas multiplicar-se-ão abundantemente no tubo digestivo do inseto. Quando ele ingere novamente sangue, poderá regurgitar grumos de formas promastigotas infectantes (metacíclicas) que se concentram na válvula estomodial.[carece de fontes].
Em vista do tempo requerido para o crescimento abundante dos flagelados e da vida curta dos insetos adultos (cerca de duas semanas ou pouco mais), é necessário que o flebotomíneo se infecte muito cedo, talvez por ocasião de suas primeiras refeições sanguíneas, para que possa efetuar a transmissão dos parasitos infectivos.[carece de fontes]
A proporção de insetos encontrados com infecção natural é sempre muito baixa. Assim, a transmissão fica na dependência de existir, como por exemplo nos focos americanos, uma densidade grande de Lutzomyia longipalpis, fato que se constata nas áreas de leishmaniose visceral, mesmo no interior das casas, sempre que haja um surto epidêmico.[carece de fontes]
No Brasil os flebotomíneos são popularmente conhecidos como mosquito palha, tatuquira, birigui, entre outros, dependendo da localização geográfica. As principais espécies envolvidas na transmissão são Lutzomyia longipalpis, Lu. cruzi, Lu. whitmani, Lu. intermedia, Lu. umbratilis, Lu. wellcomei, Lu. flaviscutellata e Lu. migonei.[22]
Os flebotomíneos representam a principal via de transmissão de Leishmania spp., entretanto mecanismos alternativos de transmissão natural estão sendo investigados. Parasitos viáveis de L. infantum foram isolados de carrapatos da espécie Rhipicephalus sanguineus (Acari: Ixodidae) que se alimentaram de cães naturalmente infectados. Esses resultados demonstram o potencial dos carrapatos como vetores de Leishmania spp., entretanto mais estudos são necessários para confirmar a competência desses animais na manutenção da leishmaniose visceral.[34]
Outro mecanismo de transmissão possível, entre os animais, é a transmissão direta, sem flebotomíneos. Em certas áreas endêmicas, observou-se a pequena densidade de insetos vetores, raros casos humanos e grande incidência do leishmaniose canina. Como os flebotomíneos aí mostravam poucas tendências em picar os cães, supôs-se que a propagação pudesse ter lugar por contato sexual, tanto mais que em diversas pesquisas pôde-se comprovar o parasitismo da glande e da uretra dos cães por Leishmania[carece de fontes].
Prevenção
As leishmanioses não são transmitidas pelo contato com pessoas infectadas, a prevenção se faz principalmente através de métodos que evitem o contato com os vetores:[carece de fontes]
- uso de repelentes, quando houver exposição a ambientes onde os vetores, habitualmente, possam ser encontrados;
- evitar a exposição nos horários de atividades do vetor (crepúsculo e noite);
- uso de mosquiteiros de malha fina (tamanho da malha 1,2 a 1,5 mm e denier 40 a 100), bem como a telagem de portas e janelas;
- manejo ambiental com limpeza de quintais e terrenos, a fim de alterar as condições do meio que propiciem o estabelecimento de criadouros para formas imaturas do vetor;
- poda de árvores, de modo a aumentar a insolação, para diminuir o sombreamento do solo e evitar as condições favoráveis (temperatura e umidade) ao desenvolvimento de larvas de flebotomíneos;
- destino adequado do lixo orgânico, a fim de se impedir a aproximação de mamíferos comensais, como marsupiais e roedores, prováveis fontes de infecção para os flebotomíneos;
- limpeza periódica dos abrigos de animais domésticos;
- manutenção de animais domésticos distantes do intradomicílio durante a noite, de modo a reduzir a atração dos flebotomíneos para esse ambiente;
- em áreas potenciais de transmissão, sugere-se uma faixa de segurança de 400 a 500 metros entre as residências e a mata. Entretanto, uma faixa dessa natureza terá que ser planejada para evitar erosão e outros problemas ambientais.[22]
Em regiões onde os humanos atuam como reservatórios para os parasitos, o tratamento dos infectados, mesmo quando assintomáticos, é essencial para o controle da doença.[16] No Brasil e em outros países, é recomendada a eutanásia de cães sororreagentes e/ou com parasitológico positivo para Leishmania como forma de controle da doença.[35]
Diferente de outros vetores de doenças, como o Aedes aegypti, os flebotomíneos não dependem de água parada para por seus ovos, fazendo-o em matéria orgânica no solo.
Diagnóstico
O diagnóstico precoce da leishmaniose é muito importante principalmente em áreas de transmissão antroponótica, onde o tratamento dos pacientes é recomendado mesmo em casos assintomáticos para evitar a transmissão da doença via vetor ou via transfusão sanguínea.[36][16] Além disso, diagnósticos rápidos e práticos são importantes pois os tratamentos possuem maior eficiência quando iniciados nas etapas iniciais da doença, principalmente para a leishmaniose visceral.[37]
Além disso, esporotricose, infecções cutâneas por Mycobacterium, hanseníase, cromoblastomicose e outros tipos de úlceras são comuns em locais endêmicos para leishmaniose cutânea e possuem sintomatologia muito similar a essa doença. Sendo assim, é necessário o diagnóstico diferencial para realizar o correto tratamento.[38]
O padrão ouro para o diagnóstico das leishmanioses é a visualização direta do parasito em microscópio óptico. Para a Leishmaniose Cutânea, aspirados do local da ferida ou esfregaços de biópsias são corados com Giemsa e examinados em busca das formas amastigotas dos parasitos.[39] Amostras de lesões também podem ser utilizados para o diagnóstico por cultivo dos parasitos em meio ágar sangue, formalmente chamado Novy, McNeal e Nicolle (NNN), ou por sua inoculação em animais suscetíveis, geralmente hamsters.[38] Essa metodologia possibilita a caracterização e identificação das espécies, entretanto é cara, trabalhosa e requer tempo para chegar ao diagnóstico.[carece de fontes]
Para a Leishmaniose Visceral, os parasitos são obtidos através de aspirados sanguíneos preferencialmente do baço, para maior sensibilidade, mas também é possível utilizar amostra da medula óssea, linfonodos ou fígado.[40]
Técnicas mais sofisticadas e caras raramente estão disponíveis nas regiões endêmicas, fazendo com que o diagnóstico direto seja amplamente utilizado. Entretanto, a sensibilidade do método depende da carga parasitária e da habilidade do examinador. É recomendado que seja utilizado sempre mais de um método para um diagnóstico mais preciso.[18]
Diversas técnicas moleculares foram desenvolvidas para o diagnóstico através da detecção do DNA de Leishmania, essas técnicas possibilitam além de confirmar a doença, identificar a espécie causadora, o que não é possível facilmente através de outros métodos.[38]
As técnicas moleculares possuem altíssima sensibilidade e especificidade e a velocidade na obtenção dos resultados, entretanto o alto custo e a necessidade de infraestrutura laboratorial e pessoas especializadas ainda limitam essa técnica em regiões endêmicas.[18]
Métodos sorológicos são bastante usados em estudos epidemiológicos, porém pouco efetivos para diagnósticos. As técnicas clássicas de sorologia, como o ELISA (Enzyme-Linked Immunosorbent Assay), o DAT (Direct Agglutination Test) e o IFAT (Immunofluorescence Antibody Test), possuem eficiência variada de acordo com a região geográfica e são trabalhosas e demoradas.[41][42] Os testes rK39 e KAtex são exemplos de kits comerciais bastante práticos e com resultados mais reproduzíveis devido a sua padronização, entretanto a sensibilidade e especificidade ainda são baixas. Além disso, os testes sorológicos falham em distinguir infecções passadas e presentes, sendo pouco útil em regiões endêmicas e no diagnóstico da LDPK.[18]
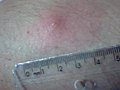
Outro método imunológico bastante comum é o teste de Montenegro, que consiste na inoculação intradérmica de antígenos de promastigotas de Leishmania e na avaliação da resposta imune no local da injeção após 48 e 72 h. O resultado é considerado positivo quando a área sensibilizada na pele é superior ou igual a 5 mm de diâmetro, em pacientes não infectados espera-se que ocorra pouca o nenhuma reação na pele. O teste sofre dos mesmos problemas das outras técnicas sorológicas e seu uso é mais comum para estudos de prevalência.[43][38]
Tratamento
As leishmanioses figuram entre as doenças tropicais negligenciadas e estão relacionadas a regiões de grande pobreza, sendo assim há pouco incentivo financeiro às industrias farmacêuticas para desenvolver tratamentos, vacinas e métodos diagnósticos eficientes. Os tratamentos disponíveis atualmente são bastante precários devido a sua longa duração, administração por via parenteral, efeitos colaterais pesados e eficácia variável. Outros medicamentos mais eficazes ainda tem seu uso limitado devido ao alto custo e dificuldades de armazenamento.[carece de fontes]
Antimoniais pentavalentes, como o Antimoniato de Meglumina (Glucantime®) e o Estibogluconato de Sódio (Pentostam®), são as drogas de primeira-linha no tratamento das leishmanioses há mais de 70 anos. Entretanto, diversos efeitos colaterais e dificuldades práticas limitam sua eficácia. Esses compostos possuem alto custo e necessitam aplicação diária por via parenteral e por um longo período (20 a 30 dias). Fraqueza, náusea, vômito, diarreia, cólicas abdominais, hepatotoxicidade e cardiotoxicidade, mialgia e dores musculares localizadas, no caso de administração via intramuscular, são efeitos colaterais típicos desses tratamentos. Apesar de serem usados a bastante tempo, ainda pouco se sabe sobre os mecanismos de ação desses medicamentos.[44]
Existem ainda drogas de segunda linha no tratamento das leishmanioses, como a Anfotericina B, a Paromomicina, a Pentamidina e a Miltefosina.[carece de fontes]
A anfotericina B é um antifúngico usado no tratamento das leishmanioses desde a década de 60.[45] A interação do fármaco com os esteróis presentes na membrana plasmática resulta na formação de um poro, causando a morte dos parasitos. Sua seletividade se deve a alta afinidade ao ergosterol, o esterol predominante na membrana de fungos, Leishmania e Trypanosoma, enquanto em mamíferos o colesterol, que possui menos afinidade pela anfotericina B, é predominante.[12]
A anfotericina B apresenta ótimas taxas de cura e relapsos são raros, contudo o tratamento também é longo e por via parenteral. Os efeitos colaterais mais comuns incluem nefrotoxicidade, hipocaliemia, febre, mal-estar severo e, em alguns casos, pode levar a morte. Sendo assim, a anfotericina B não apresenta vantagens sobre os antimoniais e é utilizada apenas em regiões onde a resistência aos antimoniais é bastante prevalente.[15]
Formulações lipossomais da anfotericina B apresentam eficácia similar a anfotericina B convencional, porém sua toxicidade é muito menor. A anfotericina B lipossomal (AmBisome®), consiste em pequenos lipossomos unilamelares compostos de colesterol e outros fosfolipídios que revestem a anfotericina B e, devido a diminuição do ritmo de excreção, aumentam a disposição da droga no plasma.[46] Enquanto o tratamento padrão com anfotericina B comum sugere doses totais de 15 a 20 mg/kg, administradas em infusões de 1 mg/kg em dias alternados, a baixa toxicidade da anfotericina B lipossomal permite dosagens maiores em um menor número de infusões.[47]
Na Índia, o estado de Bihar é responsável por cerca de 90% dos casos de LV do país e 50% dos casos do mundo. Na região o ciclo da doença é antroponótico e o uso incorreto de medicação levou à prevalência de linhagens de L. donovani resistentes aos antimoniais pentavalentes, tornando necessário o uso de medicamentos alternativos, principalmente a Anfotericina B.[48]
Nessa região, a administração de uma dose única de 10 mg/Kg de Anfotericina B lipossomal apresentou resultados comparáveis ao tratamento com Anfotericina B convencional e com menor custo, devido ao menor tempo de hospitalização necessário.[49] A administração em infusão única também contribui para evitar novos casos de resistência, pois impossibilita o abandono precoce do tratamento pelo paciente.[carece de fontes]
A Miltefosina (hexadecilfosfocolina) é o único medicamento oral disponível para o tratamento da LV, é um análogo da fosfatidilcolina e inicialmente foi desenvolvido como um medicamento anticâncer.[12] Sua administração por via oral e sua baixa toxicidade são vantagens do seu uso, entretanto o preço elevado, a fetotoxicidade e a eficácia variável aparecem como desvantagens. Os efeitos colaterais mais comuns são danos ao trato gastrointestinal, anorexia, náusea, vômito e diarreia. A eficácia do tratamento é variável entre as espécies de Leishmania e até mesmo entre populações da mesma espécie de diferentes regiões.[50] As diferenças na sensibilidade dos parasitos podem ser explicadas pelos diferentes níveis na expressão de proteínas relacionadas a internalização do medicamento. A baixa expressão do gene LbRos3 em L. braziliensis diminui a formação de complexos de transporte na membrana do parasito, explicando sua menor susceptibilidade à Miltefosina quando comparada a L. donovani.[51]
A Miltefosina também é potencialmente teratogênico, sendo seu uso contraindicado para gestantes, bem como a contracepção é recomendada para mulheres durante e de 3 a 4 meses após o tratamento com Miltefosina.[52]
Além do efeito direto sobre o parasito, a Miltefosina possui efeitos imunomodulatórios, estimulando a produção de uma série de citocinas e favorecendo a fagocitose e eliminação natural do parasita pelo sistema imune.[12]
A Paromomicina (aminosidina) é um antibiótico de amplo espectro produzido por Streptomyces rimosus e isolado a primeira vez em 1956. Apesar de ser um antibiótico antigo, apenas recentemente a Paromomicina teve seu uso aprovado para o tratamento das leishmanioses.[53] Esse composto age inibindo a síntese proteica ao se ligar a subunidade ribossomal 30S, impedindo a iniciação da tradução ou causando erros na leitura do mRNA e, consequentemente, a inserção incorreta de aminoácidos.[54]
A Paromomicina possui alta eficácia com baixo custo, baixa toxicidade e o período de administração é relativamente curto, o que faz do composto uma potencial droga de primeira-linha para o tratamento das leishmanioses em todo o mundo no futuro. Seu uso combinado com os antimoniais pentavalentes apresentou resultados muito positivos, indicando uma sinergia entre esses medicamentos, com aumento na eficácia e diminuição no tempo do tratamento.[54][53]
Reformulações da Paromomicina na forma de pomada foram desenvolvidas e apresentaram resultados variados. A busca por medicamentos de uso tópico para o tratamento da LC é interessante pela facilidade do tratamento e toxicidade baixa e restrita ao local da aplicação. Variadas formulações da Paromomicina associada com cloreto de metilbenetônio, com ureia e com gentamicina já foram testadas e mostraram resultados positivos, entretanto sua eficácia ainda é bastante variada dependendo da região e das espécies tratadas.[54][55][56][57][58]
Variações e aprimoramentos dos fármacos convencionais são alternativas pra a melhora na eficácia dos tratamentos para as leishmanioses. A administração parenteral do antimoniato de meglumina dificulta seu uso correto e causa sua rápida eliminação pela via renal, fazendo necessário a administração de múltiplas doses. A associação dos antimoniais com sistemas carreadores pode aumentar a biodisponibilidade desses fármacos pela via oral, facilitando a aplicação do tratamento e melhorando sua eficácia. A associação do antimoniato de meglumina com a β-Ciclodextrina se mostrou eficiente em facilitar a absorção pela via oral.[59]
A encapsulação dos antimoniais em lipossomos também demonstrou aumentar a eficácia, principalmente no combate à LV. Os lipossomos são usados como um sistema de carreamento, pois são naturalmente capturados pelas células do sistema fagocítico mononuclear, consequentemente causando um direcionamento maior dos fármacos aos parasitos. Testes in vivo e in vitro demonstraram que a eficiência do antimoniato de meglumina encapsulado por lipossomos é centenas de vezes maior que a mesma droga administrada livremente.[60][44] Apesar da alta eficácia, a produção de antimoniais encapsulados ainda possui limitações tecnológicas, como pouca estabilidade e baixa eficiência no encapsulamento da droga, entretanto progressos tem sido observados no aprimoramento dessas metodologias.[61][62]
À data de 2015, algumas evidências apoiavam a utilização de termoterapia em leishmaniose cutânea.[63]
Imagens adicionais
Reação intradérmica de Montenegro. Resultado reagente (após 72 Horas da inoculação).
Ver também
Referências
- ↑ 1,00 1,01 1,02 1,03 1,04 1,05 1,06 1,07 1,08 1,09 1,10 1,11 1,12 1,13 1,14 «Leishmaniasis Fact sheet N°375». World Health Organization. Janeiro de 2014. Consultado em 17 de fevereiro de 2014. Cópia arquivada em 21 de fevereiro de 2014
- ↑ 2,0 2,1 2,2 2,3 2,4 2,5 2,6 Barrett, MP; Croft, SL (2012). «Management of trypanosomiasis and leishmaniasis.». British Medical Bulletin. 104: 175–96. PMC 3530408
 . PMID 23137768. doi:10.1093/bmb/lds031
. PMID 23137768. doi:10.1093/bmb/lds031
- ↑ 3,0 3,1 «Leishmaniasis Magnitude of the problem». World Health Organization. Consultado em 17 de fevereiro de 2014. Cópia arquivada em 26 de outubro de 2013
- ↑ 4,0 4,1 GBD 2015 Disease and Injury Incidence and Prevalence, Collaborators. (8 de outubro de 2016). «Global, regional, and national incidence, prevalence, and years lived with disability for 310 diseases and injuries, 1990-2015: a systematic analysis for the Global Burden of Disease Study 2015.». Lancet. 388 (10053): 1545–1602. PMC 5055577
 . PMID 27733282. doi:10.1016/S0140-6736(16)31678-6
. PMID 27733282. doi:10.1016/S0140-6736(16)31678-6
- ↑ GBD 2015 Mortality and Causes of Death, Collaborators. (8 de outubro de 2016). «Global, regional, and national life expectancy, all-cause mortality, and cause-specific mortality for 249 causes of death, 1980-2015: a systematic analysis for the Global Burden of Disease Study 2015.». Lancet. 388 (10053): 1459–1544. PMC 5388903
 . PMID 27733281. doi:10.1016/s0140-6736(16)31012-1
. PMID 27733281. doi:10.1016/s0140-6736(16)31012-1
- ↑ Pearson, Richard. «Leishmaniose». Manual Merck. Consultado em 11 de dezembro de 2018
- ↑ David M Claborn (2010). «The Biology and Control of Leishmaniasis Vectors». J Glob Infect Dis. 2 (2): 127–134. PMID 20606968. doi:10.4103/0974-777X.62866
- ↑ 8,0 8,1 Sundar, S; Chakravarty, J (janeiro de 2013). «Leishmaniasis: an update of current pharmacotherapy.». Expert Opinion on Pharmacotherapy. 14 (1): 53–63. PMID 23256501. doi:10.1517/14656566.2013.755515
- ↑ Dorlo, TP; Balasegaram, M; Beijnen, JH; de Vries, PJ (novembro de 2012). «Miltefosine: a review of its pharmacology and therapeutic efficacy in the treatment of leishmaniasis.». The Journal of Antimicrobial Chemotherapy. 67 (11): 2576–97. PMID 22833634. doi:10.1093/jac/dks275
- ↑ Minodier, P; Parola, P (maio de 2007). «Cutaneous leishmaniasis treatment.». Travel Medicine and Infectious Disease. 5 (3): 150–8. PMID 17448941. doi:10.1016/j.tmaid.2006.09.004
- ↑ Lozano, R (15 de dezembro de 2012). «Global and regional mortality from 235 causes of death for 20 age groups in 1990 and 2010: a systematic analysis for the Global Burden of Disease Study 2010.». Lancet. 380 (9859): 2095–128. PMID 23245604. doi:10.1016/S0140-6736(12)61728-0
- ↑ 12,0 12,1 12,2 12,3 12,4 Ejazi, SA; Ali, N (janeiro de 2013). «Developments in diagnosis and treatment of visceral leishmaniasis during the last decade and future prospects.». Expert Review of Anti-infective Therapy. 11 (1): 79–98. PMID 23428104. doi:10.1586/eri.12.148
- ↑ «Neglected Tropical Diseases». cdc.gov. 6 de junho de 2011. Consultado em 28 de novembro de 2014. Cópia arquivada em 4 de dezembro de 2014
- ↑ Torres-Guerrero, Edoardo; et al. (2017). «Leishmaniasis: a review». F1000 Research
- ↑ 15,0 15,1 15,2 Pavli, Androula Maltezou, Helena C. (2010). «Leishmaniasis as an emerging infection in travelers». International Journal of Infectious Diseases
- ↑ 16,0 16,1 16,2 Michel, Grégory; et al. (Junho de 2011). «Importance of worldwide asymptomatic carriers of Leishmania infantum (L. chagasi) in human». Acta Tropica
- ↑ 17,0 17,1 Kevric, Ines Cappel, Mark A. Keeling, James H. (2015). «New World and Old World Leishmania Infections A Practical Review». Dermatologic Clinics
- ↑ 18,0 18,1 18,2 18,3 Reithinger, Richard; et al. (Setembro de 2007). «Cutaneous Leishmaniasis». The Lancet Infectious Diseases
- ↑ Alvar, Jorge; et al. (Maio de 2012). «Leishmaniasis worldwide and global estimates of its incidence». PLoS One
- ↑ 20,0 20,1 Gontijo, Célia Maria Ferreira; Melo, Maria Norma (2004). «Leishmaniose visceral no Brasil: quadro atual, desafios e perspectivas.». Revista Brasileira de Epidemiologia. 7 (3): 338–349. ISSN 1980-5497. doi:10.1590/S1415-790X2004000300011. Consultado em 19 de maio de 2020
- ↑ 21,0 21,1 Singh, Sarman Sharma, Umakant Mishra, Jyotsna (2011). «Post-kala-azar dermal leishmaniasis: Recent developments». International Journal of Dermatology
- ↑ 22,0 22,1 22,2 22,3 Ministério da Saúde (2016). «Guia de vigilância em saúde - pg. 504-542» (PDF). Brasília - DF
- ↑ 23,0 23,1 23,2 23,3 WHO. World Health Organization (2016). «WHO: Weekly epidemiological record» (PDF). Weekly Epidemiological Record
- ↑ 24,0 24,1 Pigott, David M; et al. (2014). «Global distribution maps of the Leishmaniases». eLife
- ↑ 25,0 25,1 Melo, Helen Aline Rossoni, Diogo Francisco Teodoro, Ueslei (2017). «Spatial distribution of cutaneous leishmaniasis in the state of Paraná, Brazil». PLoS One
- ↑ 26,0 26,1 dos Reis, Lisiane Lappe; et al. (2017). «Changes in the epidemiology of visceral leishmaniasis in Brazil from 2001 to 2014». Revista da Sociedade Brasileira de Medicina Tropical
- ↑ 27,0 27,1 Werneck, Guilherme Loureiro (Junho de 2014). «Visceral leishmaniasis in Brazil: rationale and concerns related to reservoir control». Revista de Saude Publica
- ↑ 28,0 28,1 Bezerra, Juliana Maria Trindade; et al. (setembro de 2018). «Burden of leishmaniasis in Brazil and federated units, 1990-2016: Findings from Global Burden of Disease Study 2016». PLOS Neglected Tropical Diseases
- ↑ 29,0 29,1 Du, Rebecca; et al. (Maio de 2016). «Old World Cutaneous Leishmaniasis and Refugee Crises in the Middle East and North Africa». PLoS Neglected Tropical Diseases
- ↑ Alvar, Jorge; Yactayo, Sergio e Bern, Caryn (2006). «Leishmaniasis and poverty». Trends in Parasitology
- ↑ Rosa, Luiz H.; et al. (2011). «Endophytic Fungi of Tropical Forests : A Promising Source of Bioactive Prototype Molecules for the Treatment of Neglected Diseases». Drug Development - A Case Study Based Insight into Modern Strategies
- ↑ 32,0 32,1 32,2 Oryan, A. Akbari, M. (2016). «Worldwide risk factors in leishmaniasis». Asian Pacific Journal of Tropical Medicine
- ↑ 33,0 33,1 Steverding, Dietmar (2017). «The history of leishmaniasis». Parasites and Vectors
- ↑ Medeiros-Silva, V.; et al. (2015). «Successful isolation of Leishmania infantum from Rhipicephalus sanguineus sensu lato (Acari: Ixodidae) collected from naturally infected dogs». BMC Veterinary Research
- ↑ Ministério da Saúde (2006). «Manual de Vigilância e Controle da Leishmaniose Visceral» (PDF). Secretaria de Vigilância em Saúde Departamento de Vigilância Epidemiológica
- ↑ Guerin, Philippe J; et al. (Agosto de 2002). «Visceral leishmaniasis: current status of control, diagnosis, and treatment, and a proposed research and development agenda». The Lancet. Infectious diseases
- ↑ Martins-Melo, Francisco Rogerlândio; et al. (2014). «Mortality and case fatality due to visceral leishmaniasis in Brazil: A nationwide analysis of epidemiology, trends and spatial patterns». PLoS ONE
- ↑ 38,0 38,1 38,2 38,3 Hiro Goto & José Angelo Lauletta Lindoso (2010). «Current diagnosis and treatment of cutaneous and mucocutaneous leishmaniasis». Expert Review of Anti-infective Therapy ISSN:
- ↑ Herwaldt, Barbara L (Outubro de 1999). «Leishmaniasis». The Lancet
- ↑ de Ruiter, C. M.; et al. (Setembro de 2014). «Molecular Tools for Diagnosis of Visceral Leishmaniasis: Systematic Review and Meta-Analysis of Diagnostic Test Accuracy». Journal of Clinical Microbiology
- ↑ Sarfaraz Ahmad Ejazi e Nahid Ali (2013). «Developments in diagnosis and treatment of visceral leishmaniasis during the last decade and future prospects». Expert Review of Anti-infective Therapy
- ↑ Mandal, Jharna; et al. (2008). «Short Report: Evaluation of Direct Agglutination Test, rk39 Test, and ELISA for the Diagnosis of Visceral Leishmaniasis» (PDF). The American Society of Tropical Medicine and Hygiene
- ↑ Antonio, Liliane de Fátima; et al. (Outubro de 2014). «Montenegro skin test and age of skin lesion as predictors of treatment failure in cutaneous leishmaniasis». Revista do Instituto de Medicina Tropical de Sao Paulo
- ↑ 44,0 44,1 Frézard, Frédéric Demicheli, Cynthia e Ribeiro, Raul R. (2009). «Pentavalent antimonials: New perspectives for old drugs». Molecules
- ↑ Croft, Simon L Sundar, Shyam e Fairlamb, Alan H (2006). «Drug Resistance in Leishmaniasis». Clinical Microbiology Reviews
- ↑ Bekersky, Ihor; et al. (2002). «Pharmacokinetics , Excretion , and Mass Balance of Liposomal Amphotericin B ( AmBisome ) and Amphotericin B Deoxycholate in Humans». Antimicrobial Agents and Chemotherapy
- ↑ Richard J. Hamill (2013). «Amphotericin B formulations: A comparative review of efficacy and toxicity». Drugs
- ↑ Shyam Sundar (2001). «Drug resistance in Indian visceral leishmaniasis». Tropical Medicine & International Health
- ↑ Sundar, Shyamgarwal, Dipti Rai, Madhukar e Murray, Henry W (2010). «Single-Dose Liposomal Amphotericin B for Visceral Leishmaniasis in India». The New England Journal of Medicine
- ↑ Machado, Paulo R.; et al. (2010). «Miltefosine in the treatment of cutaneous leishmaniasis caused by leishmania braziliensis in Brazil: A randomized and controlled trial». PLoS Neglected Tropical Diseases
- ↑ Sánchez-Cañete, María P.; et al. (2009). «Low plasma membrane expression of the miltefosine transport complex renders leishmania braziliensis refractory to the drug». Antimicrobial Agents and Chemotherapy
- ↑ Monge-Maillo, Begoña e López-Vélez, Rogelio (2015). «Miltefosine for visceral and cutaneous leishmaniasis: Drug characteristics and evidence-based treatment recommendations». Clinical Infectious Diseases
- ↑ 53,0 53,1 Viroj Wiwanitkit (2012). «Interest in paromomycin for the treatment of visceral leishmaniasis (Kala-azar)». Therapeutics and Clinical Risk Management
- ↑ 54,0 54,1 54,2 Sundar, Shyam e Jaya, Chakravarty (2008). «Paromomycin in the treatment of leishmaniasis». Expert Opinion on Investigational Drugs
- ↑ Asilian, A.; et al. (2003). «Treatment of cutaneous leishmaniasis with aminosidine (paromomycin) ointment: Double-blind, randomized trial in the Islamic Republic of Iran». Bulletin of the World Health Organization
- ↑ Weinrauch, L., Katz, M. e El On, J. (1987). «Leishmania aethiopica: topical treatment with paromomycin and methylbenzethonium chloride ointment.». Journal of the American Academy of Dermatology
- ↑ SOTO, JAIME M.; et al. (2002). «Treatment of cutaneous leishmaniasis with a topical antileishmanial drug (WR279396): phase 2 pilot study.». The American journal of tropical medicine and hygiene
- ↑ Soto, J., Fuya P., Herrera, R. e Berman, J. (1998). «Topical Paromomycin/Methylbenzethonium Chloride Plus Parenteral Meglumine Antimonate as Treatment for American Cutaneous Leishmaniasis: Controlled Study». Clinical Infectious Diseases
- ↑ Demicheli, Cynthia; et al. (2004). «Oral Delivery of Meglumine Antimoniate- β -Cyclodextrin Complex for Treatment of Leishmaniasis Oral Delivery of Meglumine Antimoniate –  -Cyclodextrin Complex for Treatment of Leishmaniasis». Antimicrobial Agents and Chemotherapy
- ↑ Alving, Carl R.; et al. (1978). «Therapy of leishmaniasis: Superior efficacies of liposome-encapsulated drugs». Proceedings of the National Academy of Sciences
- ↑ Borborema, Samanta Etel Treiger; et al. (2016). «Antimonial drugs entrapped into phosphatidylserine liposomes: Physicochemical evaluation and antileishmanial activity». Revista da Sociedade Brasileira de Medicina Tropical
- ↑ Borborema, Samanta Etel Treiger; et al. (2011). «Uptake and antileishmanial activity of meglumine antimoniate-containing liposomes in Leishmania (Leishmania) major-infected macrophages». International Journal of Antimicrobial Agents
- ↑ Von Stebut, E (março de 2015). «Leishmaniasis.». Journal der Deutschen Dermatologischen Gesellschaft = Journal of the German Society of Dermatology : JDDG. 13 (3): 191–200; quiz 201. PMID 25721626. doi:10.1111/ddg.12595











 " class="attachment-atbs-s-4_3 size-atbs-s-4_3 wp-post-image" alt="O que estudar para o enem 2023">
" class="attachment-atbs-s-4_3 size-atbs-s-4_3 wp-post-image" alt="O que estudar para o enem 2023"> " class="attachment-atbs-s-4_3 size-atbs-s-4_3 wp-post-image" alt="Qual melhor curso para fazer em 2023">
" class="attachment-atbs-s-4_3 size-atbs-s-4_3 wp-post-image" alt="Qual melhor curso para fazer em 2023"> " class="attachment-atbs-s-4_3 size-atbs-s-4_3 wp-post-image" alt="Enem: Conteúdos E Aulas On-Line São Opção Para Os Estudantes">
" class="attachment-atbs-s-4_3 size-atbs-s-4_3 wp-post-image" alt="Enem: Conteúdos E Aulas On-Line São Opção Para Os Estudantes"> " class="attachment-atbs-s-4_3 size-atbs-s-4_3 wp-post-image" alt="Como Fazer Uma Carta De Apresentação">
" class="attachment-atbs-s-4_3 size-atbs-s-4_3 wp-post-image" alt="Como Fazer Uma Carta De Apresentação"> " class="attachment-atbs-s-4_3 size-atbs-s-4_3 wp-post-image" alt="Como Escrever Uma Boa Redação">
" class="attachment-atbs-s-4_3 size-atbs-s-4_3 wp-post-image" alt="Como Escrever Uma Boa Redação"> " class="attachment-atbs-s-4_3 size-atbs-s-4_3 wp-post-image" alt="Concurso INSS edital 2022 publicado">
" class="attachment-atbs-s-4_3 size-atbs-s-4_3 wp-post-image" alt="Concurso INSS edital 2022 publicado">


