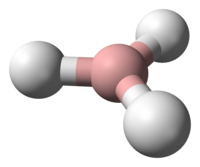
Os boranos são hidretos de boro, ou seja, compostos químicos formados exclusivamente por boro e hidrogênio. O mais simples conhecido é o BH3, ainda que sua massa molecular corresponda à do diborano B2H6. A maior parte dos boranos têm fórmulas moleculares do tipo BnHn+4 ou BnHn+6. Obtém-se por hidrólise do boreto de magnésio com ácido clorídrico diluído.
Alguns boranos típicos são B2H6, B4H10, B9H15, B10H14, B20H16. Os boranos foram produzidos pela primeira vez entre 1912 e 1936 por Alfred Stock que desenvolveu técnicas de vácuo para manejar estas substâncias tão reactivas. A síntese original de Stock, a reação do Mg3B2 com ácido, foi substituída na atualidade em todos os casos, excepto para o B6H10. A maioria das sínteses atuais implicam a termólise de B2H6 sob condições diversas, com frequência em presença de hidrogênio.
O diborano, B2H6 é um gás (Tebulição=‑92.6°) inflamável espontaneamente ao ar e que se hidrolisa instantaneamente pela ação da água, formando H2 e B(OH)3. Se obtém de maneira praticamente quantitativa por reação do borohidreto sódico com BF3.
O borano propriamente dito, BH3, tém só uma existência momentânea na descomposição térmica do diborano:
- 2 B2H6 → BH3 + B3H9
O diborano apresenta um grande número de reações. Como todos os compostos BX3 pode atuar como um ácido de Lewis e formar adutos tais como Me3NBH3, a formação do íon BH4- pode considerar-se como uma reação com H‑.
Um dos usos principais do B2H6 é como reativo extremamente versátil na síntese de organoboranos, que por sua vez são produtos intermediários muito úteis em síntese orgânica. O B2H6 também é um agente redutor poderoso de alguns grupos funcionais, por exemplo, RCHO ® RCH2 OH e RCN ® RCH2 NH2.
A reação do B2H6 com hidrocarbonetos não saturados dissolvidos em éteres, denominada comumente hidroboração, dá lugar a uma cis‑hidrogenação ou hidratação predominantemente anti‑Markovnikov.
As carbonilações em que se usa CO conduzem à formação de compostos nos que o carbono "se insere" entre o B e o C de um grupo alquilo.
Boranos superiores
Os boranos superiores, por exemplo, B6H10, são principalmente líquidos cuja inflamabilidade ao ar decresce com o aumento da massa molecular. Um dos mais importantes é o decaborano, B10H14, um sólido (Tfusão = 99.7°C) que é estável ao ar e só se hidroliza, lentamente, pela ação da água. Se obtém por aquecimento do B2H6 a 100°C e é um material de partida importante para a síntese do ânio B10H10 2- e dos carboranos.
Estruturas e ligações nos boranos
As estruturas dos boranos são únicas e distintas às de outros hidretos tais como os de carbono. Algumas delas se mostram formas parecidas aos aracnídeos, daí a denominação de aracnoboranos. Em nenhuma destas estruturas existem os elétrons suficientes para permitir a formação de ligações covalentes convencionais nas que se compartilham um par de elétrons entre átomos adjacentes (ligações do tipo 2c‑2e). Surge assim o problema da deficiência eletrônica. Para racionalizar as estruturas dos boranos se desenvolveu o primeiro dos diversos conceitos sobre a ligação policentrada. Este tipo de ligações é deficiente em elétrons, de tal manera que um só par de elétrons se encontra localizado entre três átomos, daí que as vezes se usa o termo tricentrado.
Na explicação das pontes B‑H‑B para o mais simples dos boranos, o diborano, se requerem ligações do tipo 3c‑2e, (três centros-dois elétrons). As ligações B‑H terminais podem considerar-se como ligações convencionais 2c‑2e. Deste modo, cada átomo de boro emprega dois elétrons e dois orbitais híbridos aproximadamente sp3 para formar ligações 2C‑2e com os dois átomos de hidrogênio dos extremos. O átomo de boro de cada grupo BH2 ainda possui um elétron e dois orbitais híbridos que pode empregar em ligações posteriores. O plano dos dois orbitais restantes é perpendicular ao plano BH2. Imaginemos que agora esses dois grupos BH2 se aproximam entre si em um movimento de aproximação hipotética, e que ao mesmo tempo dois átomos de hidrogênio situados também acima e por baixo do plano que formam os grupos BH2, se aproximam simultaneamente aos grupos BH2. No plano dos quatro orbitais vazios correspondentes a cada grupo BH2, se formarão agora duas ligações B‑H‑B 3c-2e. O total de quatro elétrons que requerem estas duas novas ligações tricentradas procede do elétron que possui cada átomo de H e de cada grupo BH2.
Acabamos de ver que no B2H6 se utilizam dois elementos estruturais ligados, isto é, grupos BH 2c‑2e e grupos BHB 3c‑2e. Para explicar as estruturas e ligações dos boranos superiores se necessitam estes elementos e outros três mais. Estes últimos são: grupos BB 2c‑2e, grupos BBB abertos 3c‑2e e grupos BBB fechados 3c‑2e. Estes cinco elementos estruturais ligados se representam convenientemente do seguinte modo:
- ligação boro‑hidrogênio terminal 2c‑2e
- ligação por ponte de hidrogênio 3c‑2e
- ligação boro‑boro 2c‑2e
- ligação por ponte de boro aberta 3c‑2e
- ligação de boro fechada 3c‑2e
Utilizando esses cinco elementos, Lipscomb pode desenvolver descrições "semitopológicas" de, as estruturas e ligações em todos os boranos. O esquema é suscetível de elaboração em um instrumento compreensivo e semipredictivo para correlacionar todos os dados estruturais.
O esquema semitopológico nem sempre proporciona a melhor descrição das ligações e espécies relacionadas com eles, como boranos poliédricos aniônicos e carboranos que se estudam depois. Quando existe simetria de alta ordem, com frequência, é melhor pensar em termos de uma descrição por orbitais moleculares (OM), de ligações fortemente localizados. Por exemplo, no B5H9, os quatro átomos de boro basais estão relacionados de maneira equivalente com o átomo de boro do vértice. É possível descrever um híbrido em ressonância que abarque os elementos mas resulta mais simples e elegante formular uma série de sete OM pentacentrados com os três orbitais mais baixos em energia ocupados por pares eletrônicos. Quando se tratam espécies hipersimétricas, como o B12H122‑, o uso da simetria molecular completa em um tratamento baseado na descrição por OM chega a ser o único meio prático e rigoroso.
Reatividade
Uma motivação, ainda maior, para o estudo teórico das estruturas eletrônicas destas moléculas é a compreensão de sua reatividade química. Um dos tipos mais importantes de reação que envolve os boranos (e também os ânions borano e carboranos) é a substituição eletrofílica. Aqueles átomos de boro aos que a teoria de ligação aponta a como com carga negativa maior são os atacados preferencialmente na substituição eletrofílica. Por exemplo, no B10H14, as distribuções de carga, calculadas por tratamentos de O.M., apontam um excesso considerável de carga negativa (~ 0.25e) aos átomos de boro 2 e 4, uma neutralidade aproximada aos 1 e 3 e carga positiva aos restantes. Consequentemente, os experimentos mostram que só podem substituir-se eletrofilicamente as posições 1, 2, 3 e 4 e que as 2 e 4 são ligeiramente preferidas. Se tem obtido uma concordância similar entre os resultados experimentais e as distribuições de carga calculadas para o carborano B10C2H12.
Bibliografia
- Boscke, F., ed., New Results in Boron Chemistry, Fortschritte der Chemischen Forschung, Springer Verlag, 1971.
- Brown, H. C., Boranes in Organic Chemistry, Comell University Press, 1972.
- Grimes, R. N., Carboranes, Academic Press, 1971.
- Muetterties, E. L., ed., The Chemistry of Boron and its Compounds, Wiley, 1967.
- Muetterties, E. L. y Knoth, W. H., Polyhedral Boranes, Dekker, 1968.





 " class="attachment-atbs-s-4_3 size-atbs-s-4_3 wp-post-image" alt="O que estudar para o enem 2023">
" class="attachment-atbs-s-4_3 size-atbs-s-4_3 wp-post-image" alt="O que estudar para o enem 2023"> " class="attachment-atbs-s-4_3 size-atbs-s-4_3 wp-post-image" alt="Qual melhor curso para fazer em 2023">
" class="attachment-atbs-s-4_3 size-atbs-s-4_3 wp-post-image" alt="Qual melhor curso para fazer em 2023"> " class="attachment-atbs-s-4_3 size-atbs-s-4_3 wp-post-image" alt="Enem: Conteúdos E Aulas On-Line São Opção Para Os Estudantes">
" class="attachment-atbs-s-4_3 size-atbs-s-4_3 wp-post-image" alt="Enem: Conteúdos E Aulas On-Line São Opção Para Os Estudantes"> " class="attachment-atbs-s-4_3 size-atbs-s-4_3 wp-post-image" alt="Como Fazer Uma Carta De Apresentação">
" class="attachment-atbs-s-4_3 size-atbs-s-4_3 wp-post-image" alt="Como Fazer Uma Carta De Apresentação"> " class="attachment-atbs-s-4_3 size-atbs-s-4_3 wp-post-image" alt="Como Escrever Uma Boa Redação">
" class="attachment-atbs-s-4_3 size-atbs-s-4_3 wp-post-image" alt="Como Escrever Uma Boa Redação"> " class="attachment-atbs-s-4_3 size-atbs-s-4_3 wp-post-image" alt="Concurso INSS edital 2022 publicado">
" class="attachment-atbs-s-4_3 size-atbs-s-4_3 wp-post-image" alt="Concurso INSS edital 2022 publicado">


