| style="background: #Predefinição:Chembox fundo; text-align: center;" colspan="2" | Íon amônio Alerta sobre risco à saúde | |
|---|---|

| |

| |
| |
| style="background: #Predefinição:Chembox fundo; text-align: center;" colspan="2" | Propriedades | |
| Fórmula molecular | #REDIRECT Predefinição:FormulaQuimica+ |
| Acidez (pKa) | 9.25 (25 °C) [1] |
| style="background: #Predefinição:Chembox fundo; text-align: center;" colspan="2" | Compostos relacionados | |
| Outros aniões/ânions | Anião amida (NH2-) |
| Outros catiões/cátions | Hidrônio (H3O+) Fosfónio (PH4-) Tetrametilamónio ((CH3)4N+) |
| Compostos relacionados | Amónia Cloreto de amônio |
| style="background: #Predefinição:Chembox fundo; text-align: center;" colspan="2" | Página de dados suplementares | |
| Estrutura e propriedades | n, εr, etc. |
| Dados termodinâmicos | Phase behaviour Solid, liquid, gas |
| Dados espectrais | UV, IV, RMN, EM |
| style="background: #Predefinição:Chembox fundo; text-align: center;" colspan="2" | Exceto onde denotado, os dados referem-se a materiais sob condições normais de temperatura e pressão Referências e avisos gerais sobre esta caixa. Alerta sobre risco à saúde. | |
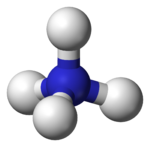
O catião amónio (português europeu) ou cátion amônio (português brasileiro) é um íon poliatómico carregado positivamente com fórmula química NH4+. Tem massa molecular 18,04 e é formado por protonação do amoníaco (NH3).
As características deste íon são semelhantes às dos íons de metais alcalinos. Por eletrólise com um cátodo de mercúrio, pode ser preparada uma amálgama de amónio que possui propriedades análogas ao amálgama de sódio ou potássio.
Os sais de amônio são geralmente compostos solúveis em água, formando soluções incolores (a menos que o ânion seja colorido). Por aquecimento todos os saís de amônio decompõem-se em amoníaco e no ácido correspondente. A menos que o ácido não seja volátil, os sais podem ser quantitativamente removidos de misturas secas por aquecimento.
As reações do ión amónio são, em geral, semelhantes às do potássio, devido ao tamanho dos íons serem quase idênticos.
Referências
- ↑ David R. Lide (2009). CRC Press Inc, ed. CRC Handbook of Chemistry and Physics (Relié) (em English). [S.l.: s.n.] 2804 páginas. ISBN 978-1-420-09084-0
Bibliografia
Vogel, A. I. Química Analítica Qualitativa. 5° Edição, 1981




 " class="attachment-atbs-s-4_3 size-atbs-s-4_3 wp-post-image" alt="O que estudar para o enem 2023">
" class="attachment-atbs-s-4_3 size-atbs-s-4_3 wp-post-image" alt="O que estudar para o enem 2023"> " class="attachment-atbs-s-4_3 size-atbs-s-4_3 wp-post-image" alt="Qual melhor curso para fazer em 2023">
" class="attachment-atbs-s-4_3 size-atbs-s-4_3 wp-post-image" alt="Qual melhor curso para fazer em 2023"> " class="attachment-atbs-s-4_3 size-atbs-s-4_3 wp-post-image" alt="Enem: Conteúdos E Aulas On-Line São Opção Para Os Estudantes">
" class="attachment-atbs-s-4_3 size-atbs-s-4_3 wp-post-image" alt="Enem: Conteúdos E Aulas On-Line São Opção Para Os Estudantes"> " class="attachment-atbs-s-4_3 size-atbs-s-4_3 wp-post-image" alt="Como Fazer Uma Carta De Apresentação">
" class="attachment-atbs-s-4_3 size-atbs-s-4_3 wp-post-image" alt="Como Fazer Uma Carta De Apresentação"> " class="attachment-atbs-s-4_3 size-atbs-s-4_3 wp-post-image" alt="Como Escrever Uma Boa Redação">
" class="attachment-atbs-s-4_3 size-atbs-s-4_3 wp-post-image" alt="Como Escrever Uma Boa Redação"> " class="attachment-atbs-s-4_3 size-atbs-s-4_3 wp-post-image" alt="Concurso INSS edital 2022 publicado">
" class="attachment-atbs-s-4_3 size-atbs-s-4_3 wp-post-image" alt="Concurso INSS edital 2022 publicado">


