Predefinição:Info/Química/Identifiers
| style="background: #Predefinição:Chembox fundo; text-align: center;" colspan="2" | Ácido tríflico Alerta sobre risco à saúde | |
|---|---|

| |

| |
| |
| Nome IUPAC | Ácido trifluormetanossulfônico |
| Outros nomes | Ácido tríflico |
| style="background: #Predefinição:Chembox fundo; text-align: center;" colspan="2" | Propriedades | |
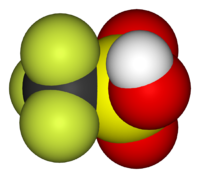
| Fórmula molecular | CF3SO3H |
| Massa molar | 150.08 g/mol |
| Aparência | Líquido incolor |
| Densidade | 1.696 g/mL |
| Ponto de fusão |
-40 °C |
| Ponto de ebulição |
162 °C |
| Solubilidade em água | Miscível |
| style="background: #Predefinição:Chembox fundo; text-align: center;" colspan="2" | Riscos associados | |
| Principais riscos associados |
Corrosivo, irritante aos olhos. |
| style="background: #Predefinição:Chembox fundo; text-align: center;" colspan="2" | Compostos relacionados | |
| Outros catiões/cátions | Triflato de lítio |
| Compostos relacionados | Ácido difluormetanossulfônico Ácido triclorometanossulfônico Ácido trifluoroacético |
| style="background: #Predefinição:Chembox fundo; text-align: center;" colspan="2" | Página de dados suplementares | |
| Estrutura e propriedades | n, εr, etc. |
| Dados termodinâmicos | Phase behaviour Solid, liquid, gas |
| Dados espectrais | UV, IV, RMN, EM |
| style="background: #Predefinição:Chembox fundo; text-align: center;" colspan="2" | Exceto onde denotado, os dados referem-se a materiais sob condições normais de temperatura e pressão Referências e avisos gerais sobre esta caixa. Alerta sobre risco à saúde. | |
O ácido trifluormetanossulfônico ou ácido tríflico é um ácido sulfônico de fórmula molecular CF3SO3H, também representado por TfOH. É um dos mais fortes ácidos conhecidos, sendo classificado como superácido por ser em torno de mil vezes mais forte que o ácido sulfúrico.[1]
Produção
Uma das várias rotas de síntese deste composto é a oxidação do derivado fluorado do metanotiol com peróxido de hidrogênio.
Segurança
O ácido tríflico em contato com a pele causa queimaduras graves e destruição dos tecidos. Na inalação, causa espasmos fatais, inflamação e edema.
Usos
É usado como catalisador em várias reações da química orgânica, já que sua base conjugada é um ótimo grupo de saída. Ao contrário do ácido sulfúrico, não "sulfona" aromáticos.
Referências
- ↑ «Ácido tríflico» (em English). Microsoft Academic. Consultado em 30 de março de 2021




 " class="attachment-atbs-s-4_3 size-atbs-s-4_3 wp-post-image" alt="O que estudar para o enem 2023">
" class="attachment-atbs-s-4_3 size-atbs-s-4_3 wp-post-image" alt="O que estudar para o enem 2023"> " class="attachment-atbs-s-4_3 size-atbs-s-4_3 wp-post-image" alt="Qual melhor curso para fazer em 2023">
" class="attachment-atbs-s-4_3 size-atbs-s-4_3 wp-post-image" alt="Qual melhor curso para fazer em 2023"> " class="attachment-atbs-s-4_3 size-atbs-s-4_3 wp-post-image" alt="Enem: Conteúdos E Aulas On-Line São Opção Para Os Estudantes">
" class="attachment-atbs-s-4_3 size-atbs-s-4_3 wp-post-image" alt="Enem: Conteúdos E Aulas On-Line São Opção Para Os Estudantes"> " class="attachment-atbs-s-4_3 size-atbs-s-4_3 wp-post-image" alt="Como Fazer Uma Carta De Apresentação">
" class="attachment-atbs-s-4_3 size-atbs-s-4_3 wp-post-image" alt="Como Fazer Uma Carta De Apresentação"> " class="attachment-atbs-s-4_3 size-atbs-s-4_3 wp-post-image" alt="Como Escrever Uma Boa Redação">
" class="attachment-atbs-s-4_3 size-atbs-s-4_3 wp-post-image" alt="Como Escrever Uma Boa Redação"> " class="attachment-atbs-s-4_3 size-atbs-s-4_3 wp-post-image" alt="Concurso INSS edital 2022 publicado">
" class="attachment-atbs-s-4_3 size-atbs-s-4_3 wp-post-image" alt="Concurso INSS edital 2022 publicado">


