Em biologia molecular, os receptores nucleares são uma classe de proteínas encontradas no interior das células e que são responsáveis por sentir a presença de hormonas e outras moléculas.[carece de fontes]
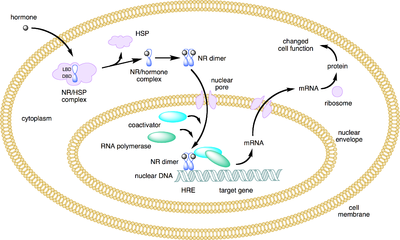
Os receptores nucleares têm a capacidade de se ligarem directamente ao ADN e regular a expressão de genes adjacentes. Como tal, estes receptores são classificados como factores de transcrição[1][2] A regulação da expressão genética pelos receptores nucleares só acontece quando um ligando, uma molécula que afecta o comportamento do receptor, está presente. Mais especificamente, a ligação do ligando a um receptor nuclear resulta numa mudança conformacional no receptor, activando-o, resultando na regulação (positiva) da expressão genética.
A propriedade única dos receptores nucleares, que os diferencia de outras classes de receptores, é a habilidade de directamente interagir e controlar a expressão do ADN. Consequentemente, os receptores nucleares assumem um papel no desenvolvimento e na homeostase do organismo. Os receptores nucleares podem ser classificados de acordo com o seu mecanismo de acção[3][4] ou através de homologias.[5][6]
Distribuição de espécies
Os receptores nucleares são específicos de metazoários (animais) e não são encontrados em protistas, algas, fungos, ou plantas.[7] Entre o início de ramificação de linhagens de animais com genomas sequenciais, dois foram relatados a partir da esponja Amphimedon queenslandica, dois do ctenóforo Mnemiopsis leidyi [8] quatro dos placozoa Trichoplax adhaerens e 17 dos cnidários Nematostella vectensis.[9] Há 270 receptores nucleares dos nematóides C. elegans sozinho.[10] Os seres humanos, camundongos e ratos têm, respectivamente, 48, 49, 47 e receptores nucleares cada um.[11]
Ligantes
Os ligantes que se ligam e ativam os receptores nucleares incluem substâncias lipofílicas, tais como os hormônios endógenos, vitaminas A e D, e xenobióticos desreguladores endócrinos. Como a expressão de um grande número de genes é regulada pelos receptores nucleares, os ligantes que ativam estes receptores podem ter efeitos profundos sobre o organismo. Muitos destes genes regulados estão associados a várias doenças, o que explica por que os alvos moleculares de aproximadamente 13% dos medicamentos aprovados pela EUA Food and Drug Administration (FDA) são receptores nucleares.[12]
Ha uma série de receptores nucleares, referidos como receptores órfãos,[13] que não se têm conhecimento (ou, pelo menos, geralmente acordado) de ligantes endógenos. Alguns destes receptores, como FXR, LXR, e PPAR ligam-se a um certo número de intermediários metabólicos, tais como ácidos graxos, ácidos biliares e / ou esteróides, com uma afinidade relativamente baixa. Estes receptores, portanto, podem funcionar como sensores metabólicos. Outros receptores nucleares, tais como o CAR e PXR parecem funcionar como sensores de xenobióticos aumentando a regulação da expressão de enzimas do citocromo P450 que metabolizam os xenobióticos.[14]
Estrutura
Os receptores nucleares são modulados em estruturas e contem os seguintes domínios: [15][16]
A-B) Domínio regulador N-terminal: contém a função de activação 1 (AF-1), cuja acção é independente da presença de ligantess.[17] A activação da transcrição do AF-1 é normalmente muito fraca, mas não sinergiza com FA-2 no domínio-E (ver abaixo) para produzir uma regulação mais robusta da expressão do gene. O domínio A-B é altamente variável em sequência entre os vários receptores nucleares.
C) Domínio de ligação do DNA (DBD): domínio altamente conservado, contendo dois dedos de zinco, que se liga a sequências específicas de DNA denominadas elementos de resposta hormonal (HRE).
D) Região da dobradiça: Pensado para ser um domínio flexível, que conecta o DBD com a LBD. Influencia tráfico intracelular e distribuição subcelular.
E) Domínio de ligação do ligante (LBD): moderadamente conservado em sequência e tem estrutura altamente conservada entre os vários receptores nucleares. A estrutura do LBD é referida como uma dobra em sanduíche alfa helicoidal, no qual três hélices alfa anti paralelas (o "enchimento sandwich") são flanqueadas por duas hélices alfa, de um lado e três do outro (o "pão"). A cavidade de ligação do ligante está no interior do LBD e logo abaixo de três "enchimentos" anti paralelos alfa helicoidais em sanduiche. Juntamente com o DBD, o LBD contribui para a interface de dimerização do receptor e, além disso, liga-se e coativa proteínas correpressoras. O LBD contém também a função de activação 2 (AF-2), cuja acção é dependente da presença de ligante ligado.[17]
F) Domínio C terminal: Altamente variável em sequência entre os vários receptores nucleares.
O N-terminal (A / B), de ligação ao DNA (C), e de ligação ao ligante (E) os domínios são independentemente bem dobrados e estruturalmente estáveis, enquanto a região de dobradiça (D) e o domínio C-terminal (F) opcional podem ser conformacionalmente flexíveis e desordenados.[18] Isto é tudo peta.
 Organização estrutural dos receptores nucleares Topo - Esquema 1D sequência de aminoácidos de um receptor nuclear. Inferior - estruturas 3D do DBD (ligado ao DNA) e LBD (ligada ao hormonio) regiões do receptor nuclear. As estruturas são indicados do receptor de estrogénio. Estruturas experimentais do domínio N-terminal (A / B), a região de dobradiça (D), e C-terminal do domínio (F) ainda não foram determinados, por conseguinte, são representados por vermelho, violeta, laranja e linhas a tracejado, respectivamente. |
Predefinição:Pfam box | Predefinição:Pfam box |
Ver também
Referências
- ↑ Evans RM (1988). «The steroid and thyroid hormone receptor superfamily». Science. 240 (4854): 889-95. PMID 3283939. doi:10.1126/science.3283939
- ↑ Olefsky JM (2001). «Nuclear receptor minireview series». J. Biol. Chem. 276 (40): 36863-4. PMID 11459855. doi:10.1074/jbc.R100047200
- ↑ Mangelsdorf DJ, Thummel C, Beato M, Herrlich P, Schutz G, Umesono K, Blumberg B, Kastner P, Mark M, Chambon P, Evans RM (1995). «The nuclear receptor superfamily: the second decade». Cell. 83 (6): 835-9. PMID 8521507. doi:10.1016/0092-8674(95)90199-X
- ↑ Novac N, Heinzel T (2004). «Nuclear receptors: overview and classification». Curr Drug Targets Inflamm Allergy. 3 (4): 335-46. PMID 15584884
- ↑ Nuclear Receptors Nomenclature Committee (1999). «A unified nomenclature system for the nuclear receptor superfamily». Cell. 97 (2): 161-3. PMID 10219237. doi:10.1016/S0092-8674(00)80726-6
- ↑ Laudet V (1997). «Evolution of the nuclear receptor superfamily: early diversification from an ancestral orphan receptor». J. Mol. Endocrinol. 19 (3): 207-26. PMID 9460643. doi:10.1677/jme.0.0190207
- ↑ Predefinição:Vcite journal
- ↑ Predefinição:Vcite journal
- ↑ Predefinição:Vcite journal
- ↑ Predefinição:Vcite journal
- ↑ Predefinição:Vcite journal
- ↑ Predefinição:Vcite journal
- ↑ Predefinição:Vcite journal
- ↑ Predefinição:Vcite journal
- ↑ Predefinição:Vcite journal
- ↑ Predefinição:Vcite journal
- ↑ 17,0 17,1 Predefinição:Vcite journal
- ↑ Predefinição:Vcite journal





 " class="attachment-atbs-s-4_3 size-atbs-s-4_3 wp-post-image" alt="O que estudar para o enem 2023">
" class="attachment-atbs-s-4_3 size-atbs-s-4_3 wp-post-image" alt="O que estudar para o enem 2023"> " class="attachment-atbs-s-4_3 size-atbs-s-4_3 wp-post-image" alt="Qual melhor curso para fazer em 2023">
" class="attachment-atbs-s-4_3 size-atbs-s-4_3 wp-post-image" alt="Qual melhor curso para fazer em 2023"> " class="attachment-atbs-s-4_3 size-atbs-s-4_3 wp-post-image" alt="Enem: Conteúdos E Aulas On-Line São Opção Para Os Estudantes">
" class="attachment-atbs-s-4_3 size-atbs-s-4_3 wp-post-image" alt="Enem: Conteúdos E Aulas On-Line São Opção Para Os Estudantes"> " class="attachment-atbs-s-4_3 size-atbs-s-4_3 wp-post-image" alt="Como Fazer Uma Carta De Apresentação">
" class="attachment-atbs-s-4_3 size-atbs-s-4_3 wp-post-image" alt="Como Fazer Uma Carta De Apresentação"> " class="attachment-atbs-s-4_3 size-atbs-s-4_3 wp-post-image" alt="Como Escrever Uma Boa Redação">
" class="attachment-atbs-s-4_3 size-atbs-s-4_3 wp-post-image" alt="Como Escrever Uma Boa Redação"> " class="attachment-atbs-s-4_3 size-atbs-s-4_3 wp-post-image" alt="Concurso INSS edital 2022 publicado">
" class="attachment-atbs-s-4_3 size-atbs-s-4_3 wp-post-image" alt="Concurso INSS edital 2022 publicado">


