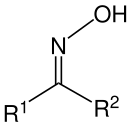
Uma oxima é uma classe de compostos orgânicos cuja fórmula geral é RR'C=NOH, onde R é um grupo organila (R ≠ H) e R' pode ser um hidrogênio (grupo hidro, R' = H) ou um grupo organila (R' ≠ H). Uma oxima é o resultado da condensação da hidroxilamina com um aldeído (sendo então chamada aldoxima) ou uma cetona (neste caso, denominada cetoxima).[1]
O termo "oxima" data do século XIX, possivelmente da contração das palavras oxigênio e imina.
Igualmente à ligação dupla dos alquenos, também aqui existe isomeria cis-trans (Z/E), quando os substituintes R e R' são diferentes. A estabilidade relativa de um isômero comparado ao outro é de se esperar que siga os mesmo critérios que para os alquenos.
As oximas são habitualmente sólidos cristalinos que, historicamente, antes da aparição dos métodos espectroscópicos, foram usadas para separar e caracterizar compostos que contivessem a função carbonilo, aldeídos e cetonas, como por exemplo monossacarídeos.
Síntese
Chama-se oximação à reação que leva à conversão de uma substância em oxima.[2]
As oximas podem ser preparadas mediante condensação, com catálise ácida, de um aldeído ou uma cetona com hidroxilamina:
- RR'C=O + NH2OH → RR'C=NOH + H2O
Chama-se amoximação a conversão de um aldeído ou uma cetona na sua oxima, mediante tratamento com amônia e peróxido de hidrogênio:[3]
- R - CHO + NH3 + H2O2 → R - CH = NOH +2H2O
Também se obtêm oximas da reação de nitritos, tais como o nitrito de isoamila, com compostos enolizáveis. Exemplos disso são a reação do acetoacetato de etila e o nitrito de sódio em ácido acético,[4][5] a reação da etil metil cetona com nitrito de etila em ácido clorídrico,[6] e uma reação similar, com nitrito de metila, com propiofenona,[7] a reação do cloreto de fenacilo[8] e a reação de malononitrilo com nitrito de sódio em ácido acético.[9]
Podem ser produzidas pela clivagem dos correspondentes aldeídos e cetonas com óxido de cálcio.[10]
Reações
Por ser uma reação reversível, a hidrólise das oximas têm lugar de forma fácil, aquecendo-se em presença de um ácido inorgânico, decompondo-se no correspondente aldeído ou cetona e na hidroxilamina. A redução de oximas mediante, por exemplo, LiAlH4 produz a amina, e com um redutor mais suave como o NaBH3CN, em uma reação análoga à aminação redutora, é possível deter a redução na correspondente hidroxilamina.
Em geral as oximas podem ser transformadas na amida por tratamento com ácido (p. ex. H2SO4 ou H3PO4). A esta reação se conhece como transposição de Beckmann, na qual o grupo hidroxilo da oxima é substituído pelo grupo que está na posição anti à sua. A transposição de Beckmann é usada na síntese industrial da caprolactama, que é o composto usado na fabricação do nylon-6.
Cloro-oximas
Os derivados clorados das oximas, as cloro-oximas, têm valiosa utilidade em síntese orgânica. Dentre esses compostos, destaca-se o 2-cloro-2-(hidroxiimino)acetato de etila, C4H6ClNO3, classificado com o número CAS 14337-43-0.[11][12]
Os derivados dessa família de compostos químicos produzem fármacos amplificadores de chaperona.[13]
Permitem a produção de alquinos por meio da condensação induzida por base de α-cloro-oximas.[14]
Referências
- ↑ (em inglês) IUPAC Compendium of Chemical Terminology, Electronic version: oximes.
- ↑ J. Biermann, Christopher; McGinnis, Gary D.. Analysis of Carbohydrates by GLC and MS
- ↑ (em inglês) Comyns, Alan E.. Encyclopedic Dictionary of Named Processes in Chemical Technology, 2014. :ammoximation Arquivado em 2 de setembro de 2017, no Wayback Machine., p.17
- ↑ Organic Syntheses, Coll. Vol. 2, p.202 (1943); Vol. 15, p.17 (1935) 2,4-DIMETHYL-3,5-DICARBETHOXYPYRROLE [2,4-Pyrroledicarboxylic acid, 3,5-dimethyl-, diethyl ester]
- ↑ Organic Syntheses, Coll. Vol. 3, p.513 (1955); Vol. 21, p.67 (1941) KRYPTOPYRROLE [Pyrrole, 2,4-dimethyl-3-ethyl]
- ↑ Organic Syntheses, Coll. Vol. 2, p.204 (1943); Vol. 10, p.22 (1930) DIMETHYLGLYOXIME [Glyoxime, dimethyl-]
- ↑ Organic Syntheses, Coll. Vol. 2, p.363 (1943); Vol. 16, p.44 (1936) ISONITROSOPROPIOPHENONE [1,2-Propanedione, 1-phenyl-, 2-oxime]
- ↑ Organic Syntheses, Coll. Vol. 3, p.191 (1955); Vol. 24, p.25 (1944) ω-CHLOROISONITROSOACETOPHENONE [Glyoxylyl chloride, phenyl-, oxime
- ↑ Organic Syntheses, Coll. Vol. 5, p.32 (1973); Vol. 48, p.1 (1968) AMINOMALONONITRILE p-TOLUENESULFONATE [Malononitrile, amino-, p-toluenesulfonate]
- ↑ H. Sharghi and M.H. Sarvari; A mild and Versatile Method for the Preparation of Oximes by use of Calcium Oxide; J. Chem. Research (S), 24—25 (2000).
- ↑ (em inglês) ChemIDplus - A TOXNET DATABASE C4-H6-Cl-N-O3 Substance Name: 2-Chloro-2-hydroxyiminoacetic acid ethyl ester (Synonyms: Chloro oxime / Ethyl chloro oximido acetate). CAS Registry Number: 14337-43-0
- ↑ Ethyl 2-chloro-2-(hydroxyimino)acetate - PubChem
- ↑ Yuefen Zhou et al; Chloro-oxime derivatives as novel small molecule chaperone amplifiers; Bioorganic & Medicinal Chemistry Letters, 2009, 19, 11, 3128-3135. DOI 10.1016/j.bmcl.2009.03.011
- ↑ Takayuki Tsuritani, et al; Base-Induced Condensation of α-Chloro Oxime Derivatives Furnishes Alkynes; Angewandte Chemie, Volume 115, Issue 45, pages 5771–5773, November 24, 2003. DOI: 10.1002/ange.200352317
Bibliografia
- K. Peter C. Vollhardt (1994), Química Orgánica, Barcelona: Ediciones Omega S.A.. ISBN 84-282-0882-4.




 " class="attachment-atbs-s-4_3 size-atbs-s-4_3 wp-post-image" alt="O que estudar para o enem 2023">
" class="attachment-atbs-s-4_3 size-atbs-s-4_3 wp-post-image" alt="O que estudar para o enem 2023"> " class="attachment-atbs-s-4_3 size-atbs-s-4_3 wp-post-image" alt="Qual melhor curso para fazer em 2023">
" class="attachment-atbs-s-4_3 size-atbs-s-4_3 wp-post-image" alt="Qual melhor curso para fazer em 2023"> " class="attachment-atbs-s-4_3 size-atbs-s-4_3 wp-post-image" alt="Enem: Conteúdos E Aulas On-Line São Opção Para Os Estudantes">
" class="attachment-atbs-s-4_3 size-atbs-s-4_3 wp-post-image" alt="Enem: Conteúdos E Aulas On-Line São Opção Para Os Estudantes"> " class="attachment-atbs-s-4_3 size-atbs-s-4_3 wp-post-image" alt="Como Fazer Uma Carta De Apresentação">
" class="attachment-atbs-s-4_3 size-atbs-s-4_3 wp-post-image" alt="Como Fazer Uma Carta De Apresentação"> " class="attachment-atbs-s-4_3 size-atbs-s-4_3 wp-post-image" alt="Como Escrever Uma Boa Redação">
" class="attachment-atbs-s-4_3 size-atbs-s-4_3 wp-post-image" alt="Como Escrever Uma Boa Redação"> " class="attachment-atbs-s-4_3 size-atbs-s-4_3 wp-post-image" alt="Concurso INSS edital 2022 publicado">
" class="attachment-atbs-s-4_3 size-atbs-s-4_3 wp-post-image" alt="Concurso INSS edital 2022 publicado">


