Predefinição:Física Nuclear O núcleo atómico (português europeu) ou atômico (português brasileiro) é constituído por prótons, que possuem carga elétrica positiva, e nêutrons que possuem ambas as cargas elétricas (negativa e positiva), o que a torna neutra. Cada protão do núcleo tenta afastar os outros devido à repulsão elétrica. Isso só não prevalece por existir uma outra força de atração entre os neutrões e os prótons, e com isso parcialmente contrabalançando a repulsão elétrica próton-próton.
Historicamente, vários modelos foram propostos para o núcleo: Modelo da gota líquida, Modelo ótico, Modelo coletivo entre muitos outros. Entretanto, o panorama do núcleo atômico só foi ficando mais claro quando a estrutura das próprias partículas elementares (próton e nêutron) foi sendo desvendada, demonstrando que estas não eram assim verdadeiramente elementares.
As forças de coesão nuclear foram propostas primeiramente com base nos modelos de múons e píons como integrantes da chamada "cola nuclear". Entretanto, os modelos atômicos mais recentes explicam que prótons e nêutrons compartilham uma sub partícula. A tal sub partícula compartilhada é um glúon. Um próton e um nêutron se comportam como dois cães brigando por um osso: ora o osso (o glúon) está com um cachorro (o próton) e ora está com o outro cachorro (o nêutron), assim eles se mantém próximos. Como são diversos prótons e diversos nêutrons, a "disputa" envolve todas as partículas e elas se mantém unidas. Essa união enfraquece se o átomo for muito grande como num átomo de urânio, por exemplo. Esses átomos muito grandes são instáveis e podem perder partes de si - processo chamado de desintegração radioativa. Existem vários modelos para explicar como o átomo é constituído. OS primeiros, como o de Dalton, tratam o átomo como uma esfera maciça, homogénea e indivisível, totalmente oposto aos fenómenos radioativos conhecidos. A radioatividade provoca alterações no núcleo e, em alguns casos, pode ser quebrado para formar novas substâncias. O modelo de Thompson explica a presença de cargas elétricas no átomo, que ainda é tido como esférico. A presença de um núcleo só começou a fazer parte dos modelos atómicos que surgiram posteriormente a Rutherford.
Propriedades básicas do núcleo atômico
O núcleo é caracterizado pelo número atómico Z e a pela massa atómica A. A carga do núcleo é determinada pelo número de cargas positivas que contém. O portador da carga elementar, , no núcleo é o protão. Dado que o átomo como um todo é eletricamente neutro, a carga nuclear determina simultaneamente o número de electrões em torno do núcleo. Em outras palavras, os elementos químicos são identificados pela sua carga nuclear ou, pelos seus números atômicos.
A massa do núcleo atômico é praticamente a mesma que a do átomo inteiro porque a massa dos electrões no átomo é insignificante. A massa do electrão é 1/1836 parte da massa do protão. É hábito medir a massa do átomo em unidades de massa atómica, abreviadamente (u.m.a.) A unidade de massa atômica (u.m.a) é a décima segunda parte, 1/12 , da massa do átomo de carbono neutro.
Spin e momento magnético
O núcleo consiste de protões e neutrões, cada um dos quais com spin . O spin nuclear é o vector soma dos momentos angulares de spin de todas as partículas componentes. Um núcleo composto por um número par de nucleões possui um spin inteiro (em unidades de ) ou spin nulo.[1]
Para além do spin nuclear, o núcleo possui um momento magnético. Assim, todas as partículas atômicas (o núcleo e os electrões) possuem um momento magnético.
O momento magnético do núcleo, é determinado pelos momentos magnéticos das suas partículas componentes. Por analogia com o magnetão de Bohr, os momentos magnéticos dos núcleos são expressos em termos do tão chamado magnetão nuclear definido como
Onde é o rácio giromagnético nuclear.[1]
Constituintes nucleares
Qual é a composição do núcleo? Como é que o átomo nuclear pode se tornar estável? Respostas a estas perguntas poderiam ser dadas somente depois da descoberta de várias propriedades do núcleo, notavelmente carga nuclear Z, massa nuclear e spin nuclear.
Notou-se que a carga nuclear é definida pela soma das cargas positivas que o núcleo contém. Dado que a carga elementar positiva é associada com o protão, a presença de protões no núcleo parecia estar para além de qualquer dúvida desde o início.
Foram também estabelecidos mais dois factos, nomeadamente:
- Notou-se que as massas dos isótopos (exceto o hidrogênio ordinário), expressas em unidades de massa de protão, eram numericamente maiores do que as suas cargas nucleares expressas em unidades de carga elementar, acentuando-se esta diferença com o aumento no Z. Para os elementos localizados no meio da tabela periódica, as massas isotópicas (u.m.a) são cerca de duas vezes maiores do que a carga nuclear. O rácio é ainda maior para os núcleos pesados. Entretanto, alguém foi forçado a pensar que os protões não eram as únicas partículas que compõem o núcleo.
- As massas dos núcleos isotópicos de todos elementos químicos sugeriram duas possibilidades: quer as partículas que compõem o núcleo possuíam quase a mesma massa, ou o núcleo continha partículas que diferiam nas suas massas até ao ponto onde a massa de algumas era insignificante em comparação à massa das outras. Isto é, a sua massa não contribuía de forma considerável, para a massa isotópica.
A última possibilidade pareceu especialmente atrativa porque estava perfeitamente de acordo com o modelo protão-electrão do núcleo. Que o núcleo poderia conter electrões pareceu resultar do facto de que o decaimento beta natural é acompanhado pela emissão de electrões. O modelo protão-electrão explicou também a razão porque os pesos atômicos isotópicos eram aproximadamente inteiros. De acordo com este modelo, a massa do núcleo deveria ser parcialmente igual às massas dos protões que o compõem, porque a massa do elétron era cerca de da massa do protão. O número de electrões no núcleo deve ser tal que a carga total devido aos protões positivos e electrões negativos é a verdadeira carga positiva do núcleo.
Por toda a sua simplicidade e lógica, o modelo protão-electrão foi refutado por avanços na Física Nuclear. Com efeito, este modelo ia contra as propriedades mais importantes do núcleo.
Se o núcleo contivesse electrões, o momento magnético nuclear deveria ser da mesma ordem de grandeza como o magnetão eletrónico de Bohr. Note que o momento magnético nuclear é definido pelo magnetão nuclear o qual é cerca de do magnetão eletrónico.[1]
Dados sobre spin nuclear, também testemunharam contra o modelo protão - electrão. Por exemplo: de acordo com este modelo, o núcleo de Berílio, deveria conter nove protões e cinco electrões de modo que a carga total deveria ser igual a quatro cargas positivas elementares. O protão e o electrão tem cada um spin semi-inteiro,. O spin total do núcleo formado por 14 partículas (nove protões e cinco electrões) deveria ser inteiro. Na verdade, o núcleo de Berílio, , possui um spin semi-inteiro de valor . Muitos mais exemplos poderiam ser citados.[1]
Último mas não menos importante, o modelo protão-electrão entrou em conflito com o princípio de incerteza de Heisenberg. Se o núcleo contivesse electrões, então a incerteza na posição do electrão, , deveria ser comparável com as dimensões lineares do núcleo, isto é, ou m. Vamos escolher o valor maior, m. A partir da relação de incerteza de Heisenberg para o momento do electrão nós temos:
O momento linear P é diretamente relacionado com a sua (energia), isto é
Uma vez conhecido o momento do electrão, pode-se prontamente determinar a sua energia. Dado que no exemplo a cima
, deverá se usar a relação relativista para a energia e momento:
Depois nós obtemos:
Este valor é excessivamente grande comparativamente a (7-8) MeV encontrado para energia de ligação através de experiências e é muitas vezes a energia dos electrões emitidos no decaimento – beta. Se, por outro lado, os electrões no núcleo era suposto possuírem energia comparável com aquela associada com as partículas emitidas no decaimento beta (poucos MeV), então a região onde os electrões devem ser localizados, isto é, o tamanho do núcleo determinado a partir das relações de incerteza deveria ser muito grande do que o determinado a partir de observações.
Um outro caminho foi encontrado quando em 1932 James Chadwick descobriu uma nova partícula fundamental.
A partir de análise das trajetórias seguidas por partículas produzidas em algumas reações nucleares e aplicando a lei de conservação de energia e de momento linear.[1] Chadwick concluiu que estas trajetórias somente poderiam ser seguidas por partículas com massa ligeiramente maior do que a massa do protão e com carga nulo. Por essa razão, a nova partícula foi chamada neutrão. De acordo com as visões atuais, o núcleo consiste de nucleões: protões e neutrões. Como a massa do núcleo é cerca de 2 000 vezes a massa do electrão, o núcleo praticamente carrega toda a massa do átomo. O nuclídeo é uma combinação específica de um número de protões e neutrões. O símbolo completo para o nuclídeo é escrito como:
Onde X é o símbolo químico do elemento, Z é o número atómico, dando o número de protões no núcleo. A é o número total de nucleões no núcleo. É também conhecido como o número de massa. N = A - Z é o número de neutrões. Na Física Nuclear diz-se que o protão e o neutrão são dois estados de carga da mesma partícula, o nucleão. O protão é o estado protónico do nucleão com carga +e, e o neutrão é o seu estado neutrónico com carga nula. De acordo com os dados mais recentes, a massa de repouso do protão e a do neutrão é respectivamente igual a:
O protão e o neutrão possuem o mesmo número de massa igual a unidade. No núcleo, os nucleões estão em estados que substancialmente diferem dos seus estados livres. A razão disto é que em todos os núcleos, excepto o do hidrogénio ordinário, existem pelo menos dois nucleões entre os quais existe uma interação nuclear especial ou emparelhamento. O modelo protão – neutrão do núcleo conta para ambos, valores observados de massas isotópicas e os momentos magnéticos dos núcleos. Dado que os momentos magnéticos do protão e neutrão são da mesma ordem de grandeza que o magnetão nuclear, segue que o núcleo composto de nucleões deveria ter um momento magnético da mesma ordem de grandeza que o magnetão nuclear. Portanto, com protões e neutrões como entidades constituintes dos núcleos, o momento magnético deveria ser da mesma ordem de grandeza. Observações confirmaram este fato.[1]
é a escala de comprimento típica da Física Nuclear.
Além disso, com os protões e neutrões como constituintes dos núcleos, o princípio de incerteza leva a um valor razoável de energia para estas partículas no núcleo, em completo acordo com as energias observadas por partícula.
Finalmente, com a suposição de que os núcleos são compostos de neutrões e protões, a dificuldade que surge do spin nuclear também foi resolvida. Entretanto, se o núcleo contém um número par de nucleões, tem um spin inteiro (em unidades de ). Com um número impar de nucleões, o seu spin será semi – inteiro em unidades de ).[1]
Energia de ligação Nuclear
Núcleos atómicos contendo protões electrizados positivamente e neutrões não eletrizados perfazem sistemas estáveis apesar do facto de que os protões experimentam repulsão de Coulomb. A estabilidade dos núcleos é uma indicação de que deve existir uma espécie de força de ligação entre os nucleões. A força de ligação pode ser investigada na base considerações energéticas apenas, sem evocar quaisquer considerações que dizem respeito à natureza e propriedades das forças nucleares.
A ideia sobre a intensidade das forças de ligação no sistema pode ser obtida a partir do esforço necessário para quebrá-lo, isto é, para realizar trabalho contra as forças de ligação.
Este procedimento leva aos vários fatos importantes sobre as forças que mantém os nucleões no núcleo. A energia necessária para remover qualquer nucleão do interior do núcleo é chamada energia de ligação (ou separação) do nucleão no núcleo. É igual ao trabalho que deve ser realizado para remover o nucleão a partir do núcleo sem comunicar-lhe qualquer energia cinética.
A energia de ligação total do núcleo é definida como o valor do trabalho que deve ser realizado para quebrar o núcleo em seus nucleões constituintes. A partir da lei de conservação de energia segue que ao formar o núcleo, a mesma quantidade de energia deve ser libertada como a que foi fornecida ao núcleo para quebrá-lo.
O valor da energia de ligação dos núcleos pode ser estimado a partir das seguintes considerações. Foi descoberto que a massa em repouso de qualquer núcleo permanentemente estável é menor do que a soma das massas em repouso dos nucleões que ele contém. Tudo se passa como se, ao ´´empacotar´´ os protões e neutrões para formar o núcleo, eles perdessem alguma de suas massas.
Uma explicação desse fenômeno é dada pela teoria da relatividade especial. Este fato é levado em conta pela conversão duma parte da massa das partículas em energia de ligação. A energia de repouso do corpo, , é relacionada à sua massa de repouso pela expressão:
Onde c é a velocidade da luz no vácuo. Designando a energia libertada durante a formação do núcleo como , então a massa equivalente da energia de ligação total
é o decréscimo na massa em repouso a medida que os nucleões se juntam para formar o núcleo. A grandeza é também conhecida como defeito de massa ou decremento de massa. Se um núcleo de massa M é composto de um número Z de protões com massa e dum número A - Z de neutrões com a massa , a grandeza é dada por:
A grandeza dá a medida da energia de ligação,
Na Física Nuclear, as energias são expressas em unidades de energia atómicas (uea) correspondendo à unidades de massa atómica:
Assim, para determinar a energia de ligação em MeV, deverá se usar a equação:
Onde as massas dos nucleões e a massa do núcleo são expressos em unidades de massa atómica. Em média, a energia de ligação por nucleão é cerca de 8 MeV, a qual é justamente um valor grande.
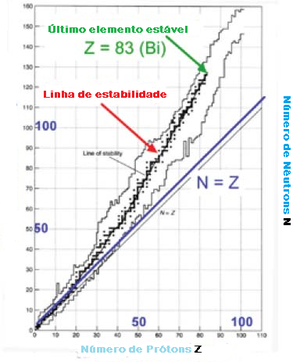
Estabilidade Nuclear
Nem todos os núcleos são estáveis. Núcleos instáveis sofrem decaimentos radioativos em transformam-se em núcleos diferentes. Núcleos estáveis têm aproximadamente números iguais de neutrões e protões N = Z para pequenos A <20 e pequenos excessos de neutrões para A maiores, como mostra o diagrama.
Núcleos: Estabilidade versus razão N/Z
- 3000 núcleos conhecidos, apenas 266 são estáveis. -Z > 83 elementos não estáveis.
- Tendência para N = Z,
mas N > Z para Z de valores elevados (devido à repulsão entre protões)
- Estabilidade não usual para
´´números mágicos´´.
Z , N = 2, 8, 20, 28, 50, 82, 126
(análogo à capas/camadas electrónicas)
O princípio de exclusão de Pauli ajuda a perceber o facto de que núcleos com iguais Z e N são estáveis. Imagine preenchendo uma caixa unidimensional com protões e neutrões.
Nós precisamos da configuração de energia mínima para um dado valor de A, seja 5. Dado que ambos, neutrões e protões possuem spin ½, eles são fermiões (como electrões) e por consequência obedecem o princípio de exclusão de Paulí. Este princípio restringe o número de protões e neutrões à 2 para cada em cada nível energético. Recorde-se que a energia do n (enésimo) nível de energia numa caixa unidimensional é dada por , onde é a energia do nível fundamental.
Se todos os cinco nucleões fossem electrões, a energia total do núcleo seria como é mostrado no diagrama A. Em contraste, se 3 fossem neutrões e 2 protões (como mostrado em B), a energia seria a qual é muito menor. Esta simples imagem mostra que é mais energeticamente favorável ter N ~ Z.
Se incluirmos a repulsão de Coulomb entre protões, os níveis de energia de protões tornam-se maiores do que os níveis de energia dos neutrões. A menina A aumenta, torna-se mais favorável ter um pequeno excesso neutrões.
Alguns elementos possuem mais isótopos estáveis que outros. Os elementos com maior número de isótopos estáveis têm valores de Z de 2, 8, 20, 28, 50, 82 e 126. Estes são chamados números mágicos, porque a razão da estabilidade não foi compreendida na altura da sua descoberta. Por exemplo, Cálcio (Z = 20) tem 6 isótopos estáveis enquanto Potássio (Z = 19) e Escândio (Z = 21) possuem somente 2 isótopos estáveis cada. De forma semelhante, núcleos com N igual a número mágico tem um número maior que o valor médio de isotones (isotone tem valores de N iguais e diferentes valores de Z).
Núcleos com A ~ 60 são mais estreitamente ligados juntos e assim eles estão em níveis de energia baixos do que os demais. (Energia de ligação é análoga a energia necessária para elevar um balde de água a partir do poço. Uma energia de ligação maior significa que a água está baixa no poço, isto é, a água está num nível baixo). Se dois núcleos leves com A << 60 são postos juntos eles criam novos núcleos num estado com energia de repouso baixa (isto é chamado fusão). Além disso um núcleo pesado com A>> 60 pode-se dividir em dois núcleos de energia de repouso baixa (isto é chamado fissão).
Abundância isotópica e de Massa
A abundância relativa de um isótopo na natureza comparado a outros isótopos do mesmo elemento é relativamente constante. O gráfico dos nuclídeos apresenta a abundância relativa de isótopos de elementos que ocorrem naturalmente em unidades de átomos porcento.
Átomo porcento é a percentagem de átomos de um elemento que são de um isótopo particular. Átomo porá percentagem do peso do elementocento é abreviado como a/o.
Por exemplo, se um copo de água contém átomos de Oxigénio, e a abundância isotópica do Oxigénio – 18 é 0,20%, então o existem átomos de Oxigénio – 18 no copo.
O peso atómico para o elemento é definido como o peso atómico médio dos isótopos do elemento. O peso atómico para o elemento é calculado pela soma dos produtos da abundância isotópica do isótopo com a massa atómica do isótopo.
Exemplo
Calcule o peso atómico para o elemento Lítio. Lítio – 6 tem abundância de átomo por cento de 7,5 % e uma massa atómica de 6,015122 u.m.a. Lítio – 7 tem abundância atómica de 92,5 % e uma massa atómica de 7,016003 u.m.a
Solução:
A outra medida mais comum da abundância isotópica é o peso porcento (w/o).
Peso porcento é a percentagem do peso dum elemento que é isótopo particular. Por exemplo, se a amostra de um material contém 100 kg de Urânio que era 28 w/o Urânio – 235, então 28 kg de Urânio – 235 estava presente na amostra.
Referências
- ↑ 1,0 1,1 1,2 1,3 1,4 1,5 1,6 [http://oer.avu.org/bitstream/handle/123456789/162/Fisica%20Nuclear.pdf?sequence=1 Telahun Tesfaye, Dr. FÍSICA NUCLEAR. 128 págs. Creative Commons Atribuição-Partilha (versão 2.5) ISBN 14 de agosto de 2013.





































![{\displaystyle \Delta E_{b}=\Delta m_{b}.c^{2}=[Zm_{p}+(A-Z)m_{n}-M]c^{2}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/24a59ec63b8f08e2d92c817efa6ddbfe383bd5a0)



![{\displaystyle \Delta E_{b}=[Zm_{p}+(A-Z)m_{n}-M]\times 931,1MeV}](https://wikimedia.org/api/rest_v1/media/math/render/svg/53b238ca7f82a51f61fc117a9bf2e25bc1cb02f4)


![{\displaystyle \scriptstyle [9+(2\times 4)+(2\times 1)]E_{1}=19E_{1}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/6f011611283b3fa0d4c8fa5475ded2224a5c8e86)
![{\displaystyle \scriptstyle [4+(4\times 1)].E_{1}=8E_{1}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/4c83251d7fba343069b6dd5e5c9187be411b2f27)




 " class="attachment-atbs-s-4_3 size-atbs-s-4_3 wp-post-image" alt="O que estudar para o enem 2023">
" class="attachment-atbs-s-4_3 size-atbs-s-4_3 wp-post-image" alt="O que estudar para o enem 2023"> " class="attachment-atbs-s-4_3 size-atbs-s-4_3 wp-post-image" alt="Qual melhor curso para fazer em 2023">
" class="attachment-atbs-s-4_3 size-atbs-s-4_3 wp-post-image" alt="Qual melhor curso para fazer em 2023"> " class="attachment-atbs-s-4_3 size-atbs-s-4_3 wp-post-image" alt="Enem: Conteúdos E Aulas On-Line São Opção Para Os Estudantes">
" class="attachment-atbs-s-4_3 size-atbs-s-4_3 wp-post-image" alt="Enem: Conteúdos E Aulas On-Line São Opção Para Os Estudantes"> " class="attachment-atbs-s-4_3 size-atbs-s-4_3 wp-post-image" alt="Como Fazer Uma Carta De Apresentação">
" class="attachment-atbs-s-4_3 size-atbs-s-4_3 wp-post-image" alt="Como Fazer Uma Carta De Apresentação"> " class="attachment-atbs-s-4_3 size-atbs-s-4_3 wp-post-image" alt="Como Escrever Uma Boa Redação">
" class="attachment-atbs-s-4_3 size-atbs-s-4_3 wp-post-image" alt="Como Escrever Uma Boa Redação"> " class="attachment-atbs-s-4_3 size-atbs-s-4_3 wp-post-image" alt="Concurso INSS edital 2022 publicado">
" class="attachment-atbs-s-4_3 size-atbs-s-4_3 wp-post-image" alt="Concurso INSS edital 2022 publicado">


