| Sarcoma de Ewing | |
|---|---|
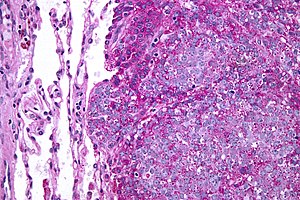
| Fotografia miscroscópica de sarcoma de Ewing metastático (direita) em tecido pulmonar normal (esquerda). Coloração ácido periódico-Schiff. | |
| Sinónimos | Tumor ectodérmico primitivo periférico, tumor de Askin, família de tumores de Ewing[1] |
| Especialidade | Oncologia |
| Sintomas | Inflamação e dor perto do tumor[1] |
| Complicações | Derrame pleural, paraplegia[2] |
| Início habitual | 10 a 20 anos de idade[3][2] |
| Causas | Desconhecidas[2] |
| Método de diagnóstico | Biópsia aos tecidos[1] |
| Condições semelhantes | Osteossarcoma, neuroblastoma, osteomielite, granuloma eosinofílico[2] |
| Tratamento | Quimioterapia, radioterapia, cirurgia, transplante de células estaminais[1] |
| Prognóstico | Taxa de sobrevivência a 5 anos ~ 70%[3] |
| Frequência | 1 em cada milhão (EUA)[3] |
| Classificação e recursos externos | |
| CID-9 | 170.9 |
| OMIM | 133450 |
| DiseasesDB | 4604 |
| MedlinePlus | 001302 |
| eMedicine | ped/2589 |
| MeSH | Predefinição:Mesh2 |
Sarcoma de Ewing é um tipo de cancro que se forma no osso ou nos tecidos moles.[1] Os sintomas mais comuns são inflamação e dor no local do tumor, febre e fratura óssea.[1] As regiões onde é mais comum formar-se são as pernas, a bacia e a parede da cavidade torácica.[3] Em cerca de 25% dos casos, no momento em que é diagnosticado o cancro já se espalhou para outras partes do corpo.[3] Entre as possíveis complicações estão um derrame pleural e paraplegia.[2]
Desconhecem-se as causas da doença.[2] A maior parte dos casos aparenta ocorrer de forma aleatória.[2] Muitas vezes o sarcoma de Ewing é agrupado com outros tumores neuroectodérmicos primitivos numa categoria denominada família de Tumores de Ewing.[2] Em muitos casos, o mecanismo subjacente envolve uma alteração genética denominada translocação recíproca.[2] O diagnóstico é feito com uma biópsia aos tecidos do tumor.[1]
Geralmente o tratamento consiste em quimioterapia, radioterapia, cirurgia e transplante de células estaminais.[1] Está a ser estudado o uso de terapia dirigida e imunoterapia.[1] A taxa de sobrevivência a cinco anos é de cerca de 70%.[3] No entanto, esta estimativa é influenciada por uma série de fatores.[3]
A doença é assim denominada em homenagem ao patologista norte-americano James Ewing, que em 1920 determinou que o tumor é um tipo de cancro distinto.[4][5] Nos Estados Unidos, a doença afeta cerca de uma em cada milhão de pessoas por ano.[3] O sarcoma de Ewing é mais comum entre adolescentes e jovens adultos e corresponde a 2% de todos os cancros pediátricos.[1][2] A doença é mais comum entre pessoas caucasianas e afeta mais homens do que mulheres.[3]
Causas
O sarcoma de Ewing é o resultado de uma translocação entre os cromossomos 11 e 22, que fucionam o gene EWS do cromossomo 22 com o gene FLI1 do cromossomo 11.
O EWS/FLI funciona como o regulador principal.[6]
Outras translocações possíveis são em t(21;22)[7] e t(7;22).[8]
Diagnóstico
Na histologia, o sarcoma de Ewing é conhecido como um tumor de pequenas células redondas e azuis. Geralmente aparece como uma saliência no osso, detectada por meio de biópsias. Se apresentam como dolorosas massas crescentes e o local afetado frequentemente é sensível, quente e edemaciado. Alguns pacientes apresentam achados sistemicos, incluindo febre, elevação da velocidade de hemossedimentação, anemia e leucocitose, que mimetizam uma infeção.
O sarcoma de Ewing é mais comum em homens e geralmente se manifesta na infância ou início da vida adulta, com um pico de ocorrência entre 10 e 20 anos de idade. Pode ocorrer em qualquer região do corpo, mas ocorre mais frequentemente na pelve e nos ossos tubulares longos. As diáfises do fêmur são os locais mais comuns, seguidos pela tíbia e úmero. Trinta por cento são metastáticos na sua apresentação.
É um tumor positivo para o marcador CD99 e negativo para o CD45.[9]

Na radiografia convencional, a apresentação óssea mais comum é uma lesão lítica com zona de transição e com reação do periósteo. A descrição clássica de uma reação do periósteo lamelada ou do tipo "casca de cebola" é frequentemente associada com a lesão. As radiografias acrescentam informações importantes para a avaliação ou pesquisa. A ampla zona de transição é a característica mais útil na radiografia para a diferenciação entre lesões líticas agressivas e lesões líticas benignas.
A ressonância magnética deve ser usada rotineiramente para avaliação dos tumores malignos. Ela irá mostrar a extensão no osso e tecido mole e relacionar o tumor a outras estruturas anatômicas próximas (como vasos, por exemplo). O contraste com gadolínio não é necessário já que ele não fornece informações adicionais em comparação com estudos não contrastados. No entanto, alguns estudos atuais sugerem que uma ressonância magnética com contraste pode ajudar a determinar a quantidade de necrose no interior do tumor, ajudando a determinar a resposta ao tratamento antes da cirurgia.
A tomografia computadorizada também pode ser usada para definir a extensão extra-óssea do tumor, especialmente no crânio, coluna vertebral, costelas e pelve. Tanto a tomografia computadorizada quando a ressonância magnética podem ser usados para acompanhar a resposta à radiação e/ou à quimioterapia.
A cintilografia óssea também pode ser usada para avaliar a resposta tumoral após a terapia.
Tratamento
O tratamento, em todas as circunstâncias, consiste em quimioterapia, geralmente incluindo drogas como a ifosfamida e a doxorrubicina, a fim de evitar o risco de desenvolvimento do tumor por metástase. Caso seja possível detectar a localização do tumor, é realizada uma cirurgia. No caso de não haver necrose total das células, geralmente inclui-se também a radioterapia.
Prognóstico
A sobrevivência depois desse tipo de câncer sem reincidência varia entre 65% a 70% dos casos. Para os pacientes que apresentam metástase, o grau de sobrevivência é entre 25% a 30%.
História
O tumor recebe o nome em homenagem a James Ewing (1866-1943), patologista norte-americano, primeira pessoa a descrever o tumor, estabelecendo que a doença era separada do linfoma e outras causas de câncer conhecidas naquela época.[10][11]
Referências
- ↑ 1,0 1,1 1,2 1,3 1,4 1,5 1,6 1,7 1,8 1,9 «Ewing Sarcoma Treatment». National Cancer Institute (em English). 25 de janeiro de 2019. Consultado em 3 de fevereiro de 2019
- ↑ 2,0 2,1 2,2 2,3 2,4 2,5 2,6 2,7 2,8 2,9 «Ewing Sarcoma». NORD (National Organization for Rare Disorders). 2013. Consultado em 4 de fevereiro de 2019
- ↑ 3,0 3,1 3,2 3,3 3,4 3,5 3,6 3,7 3,8 «Ewing Sarcoma Treatment». National Cancer Institute (em English). 31 de janeiro de 2019. Consultado em 4 de fevereiro de 2019
- ↑ «Ewing's sarcoma». Whonamedit. Consultado em 4 de fevereiro de 2019
- ↑ Ewing J (setembro de 2006). «The Classic: Diffuse endothelioma of bone. Proceedings of the New York Pathological Society. 1921;12:17». Clinical Orthopaedics and Related Research. 450: 25–7. PMID 16951641. doi:10.1097/01.blo.0000229311.36007.c7
- ↑ Owen LA, Kowalewski AA, Lessnick SL (2008). «EWS/FLI mediates transcriptional repression via NKX2.2 during oncogenic transformation in Ewing sarcoma». PLoS ONE. 3 (4): e1965. PMID 18414662. doi:10.1371/journal.pone.0001965
- ↑ Sorensen PH, Lessnick SL, Lopez-Terrada D, Liu XF, Triche TJ, Denny CT (1994). «A second Ewing's sarcoma translocation, t(21;22), fuses the EWS gene to another ETS-family transcription factor, ERG». Nat. Genet. 6 (2): 146–51. PMID 8162068. doi:10.1038/ng0294-146
- ↑ Jeon IS, Davis JN, Braun BS; et al. (1995). «A variant Ewing's sarcoma translocation (7;22) fuses the EWS gene to the ETS gene ETV1». Oncogene. 10 (6): 1229–34. PMID 7700648
- ↑ Bernstein M, Kovar H, Paulussen M; et al. (2006). «Ewing sarcoma family of tumors: current management». Oncologist. 11 (5): 503–19. PMID 16720851. doi:10.1634/theoncologist.11-5-503
- ↑ Predefinição:WhoNamedIt
- ↑ J. Ewing. Diffuse endothelioma of bone. Proceedings of the New York Pathological Society, 1921, 17-24.




 " class="attachment-atbs-s-4_3 size-atbs-s-4_3 wp-post-image" alt="O que estudar para o enem 2023">
" class="attachment-atbs-s-4_3 size-atbs-s-4_3 wp-post-image" alt="O que estudar para o enem 2023"> " class="attachment-atbs-s-4_3 size-atbs-s-4_3 wp-post-image" alt="Qual melhor curso para fazer em 2023">
" class="attachment-atbs-s-4_3 size-atbs-s-4_3 wp-post-image" alt="Qual melhor curso para fazer em 2023"> " class="attachment-atbs-s-4_3 size-atbs-s-4_3 wp-post-image" alt="Enem: Conteúdos E Aulas On-Line São Opção Para Os Estudantes">
" class="attachment-atbs-s-4_3 size-atbs-s-4_3 wp-post-image" alt="Enem: Conteúdos E Aulas On-Line São Opção Para Os Estudantes"> " class="attachment-atbs-s-4_3 size-atbs-s-4_3 wp-post-image" alt="Como Fazer Uma Carta De Apresentação">
" class="attachment-atbs-s-4_3 size-atbs-s-4_3 wp-post-image" alt="Como Fazer Uma Carta De Apresentação"> " class="attachment-atbs-s-4_3 size-atbs-s-4_3 wp-post-image" alt="Como Escrever Uma Boa Redação">
" class="attachment-atbs-s-4_3 size-atbs-s-4_3 wp-post-image" alt="Como Escrever Uma Boa Redação"> " class="attachment-atbs-s-4_3 size-atbs-s-4_3 wp-post-image" alt="Concurso INSS edital 2022 publicado">
" class="attachment-atbs-s-4_3 size-atbs-s-4_3 wp-post-image" alt="Concurso INSS edital 2022 publicado">


