A Predefinição:Pbpe é a quantidade de tempo característica de um decaimento exponencial. Se a quantidade que decai possui um valor no início do processo, na meia-vida a quantidade terá metade deste valor.
Nos processos radioativos, meia-vida ou período de semidesintegração de um radioisótopo é o tempo necessário para desintegrar a metade da massa deste isótopo, que pode ocorrer em segundos ou em bilhões de anos, dependendo do grau de instabilidade do radioisótopo. Ou seja, se tivermos 100 kg de um material, cuja meia-vida é de 100 anos; depois desses 100 anos, teremos 50 kg deste material. Mais 100 anos e teremos 25 kg, mais 100 anos e teremos 12,5 kg, mais 100 anos 6,25 kg, mais 100 anos 3,125 kg, mais 100 anos 1,5625 kg, mais 100 anos 0,78125 kg e assim sucessivamente.
No caso do carbono-14 a meia-vida é de 5.730 anos, ou seja, este é o tempo necessário para uma determinada massa deste isótopo instável decair para a metade da sua massa, transformando-se em nitrogênio-14 pela emissão de uma partícula beta.
Esta medida da meia-vida é utilizada para a datação de fósseis e elementos químicos radioativos.
Alguns elementos possuem meia-vida muito baixa, mesmo para os seus isótopos menos instáveis. Alguns elementos transurânicos (elementos com número atômico acima de 92) apresentam meias-vidas de 1 segundo enquanto o urânio-238 apresenta meia-vida de aproximadamente 5.000.000.000 anos que é a idade calculada da Terra.
Não confundir com vida-média de um radioisótopo, que é o tempo médio que um átomo de um radioisótopo leva para decair ou desintegrar.
Meia-vida radiológica diz respeito ao tempo de desintegração de um núcleo atômico instável até sua atividade radiológica atingir a metade, não diz respeito a sua massa, que a exceção das desintegrações do tipo alfa emissoras e a fissão nuclear que perdem massa, as demais transições não alteram significativamente a sua massa.[1]
Natureza probabilística
O tempo de meia-vida usualmente descreve o decaimento de entidades discretas, como átomos radioativos. Neste caso, preferencialmente não se utiliza a definição "tempo de meia-vida é o tempo necessário para que exatamente metade das partículas sofram decaimento". Por exemplo, se existe apenas um átomo radioativo, e seu tempo de meia-vida é de 1 segundo, não faz sentido afirmar que, após decorrido este tempo, houvesse "metade de um átomo".
Ao invés disso, a meia-vida é definida em termos probabilísticos: "Meia-vida é o tempo necessário para que, em média, metade dos átomos sofram decaimento".[2]

Por exemplo, a imagem ao lado é uma simulação de vários átomos idênticos sofrendo o processo de decaimento. Note que, após transcorrido um tempo de meia-vida, não existem exatamente a metade dos átomos remanescentes, mas sim, aproximadamente esta quantidade, devido a variações randômicas do processo. Entretanto, quando existe um grande número de átomos idênticos sofrendo decaimento (conforme mostra a caixa da direita), a lei dos grandes números sugere que a aproximação ao estimar que metade da quantidade dos átomos sofrerão decaimento é válida.
Determinação do tempo de meia vida
O tempo de meia-vida pode ser determinado de acordo com a ordem da reação.
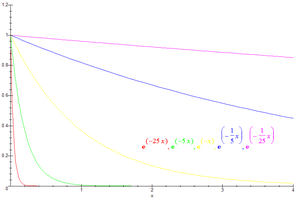
Para uma cinética de primeira ordem, como o decaimento é exponencial, vem que o tempo de meia-vida independe da concentração inicial.
Onde k é a constante de velocidade. Esta equação é utilizada na determinação do tempo de meia-vida de processos envolvendo decaimentos radioativos, uma vez que estes seguem uma cinética de primeira ordem.[3]
Caso a reação siga uma cinética de segunda ordem, como o comportamento do decaimento é não exponencial, o tempo de meia vida pode ser determinado por:
Onde [A]0 é a concentração inicial do reagente A, em mol/L.
Para processos de ordem zero, podemos facilmente determinar o tempo de meia vida a partir de: [4]
Ver também
Referências
- ↑ Feltre, Ricardo (2004). Química. São Paulo: Moderna. pp. 365–380
- ↑ Muller, Richard A. (12 de abril de 2010). Physics and Technology for Future Presidents. [S.l.]: Princeton University Press. pp. 128–129. ISBN 9780691135045
- ↑ Paulo César (12 de novembro de 2011). «Ordens da reação». Consultado em 16 de dezembro de 2019
- ↑ Atkins, Peter (2012). Princípios de Química. Porto Alegre: Bookman. pp. 576–578





![{\displaystyle t_{1/2}={\frac {1}{k[A]_{0}}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/581d7104d55f5bd128b507ed4722ffcfcfd89ccb)
![{\displaystyle t_{1/2}={\frac {[A]_{0}}{2k}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/406e22f160a25df415f5b82c4ffcba55d2cad9fa)
 " class="attachment-atbs-s-4_3 size-atbs-s-4_3 wp-post-image" alt="O que estudar para o enem 2023">
" class="attachment-atbs-s-4_3 size-atbs-s-4_3 wp-post-image" alt="O que estudar para o enem 2023"> " class="attachment-atbs-s-4_3 size-atbs-s-4_3 wp-post-image" alt="Qual melhor curso para fazer em 2023">
" class="attachment-atbs-s-4_3 size-atbs-s-4_3 wp-post-image" alt="Qual melhor curso para fazer em 2023"> " class="attachment-atbs-s-4_3 size-atbs-s-4_3 wp-post-image" alt="Enem: Conteúdos E Aulas On-Line São Opção Para Os Estudantes">
" class="attachment-atbs-s-4_3 size-atbs-s-4_3 wp-post-image" alt="Enem: Conteúdos E Aulas On-Line São Opção Para Os Estudantes"> " class="attachment-atbs-s-4_3 size-atbs-s-4_3 wp-post-image" alt="Como Fazer Uma Carta De Apresentação">
" class="attachment-atbs-s-4_3 size-atbs-s-4_3 wp-post-image" alt="Como Fazer Uma Carta De Apresentação"> " class="attachment-atbs-s-4_3 size-atbs-s-4_3 wp-post-image" alt="Como Escrever Uma Boa Redação">
" class="attachment-atbs-s-4_3 size-atbs-s-4_3 wp-post-image" alt="Como Escrever Uma Boa Redação"> " class="attachment-atbs-s-4_3 size-atbs-s-4_3 wp-post-image" alt="Concurso INSS edital 2022 publicado">
" class="attachment-atbs-s-4_3 size-atbs-s-4_3 wp-post-image" alt="Concurso INSS edital 2022 publicado">


