| Distrofia muscular | |
|---|---|
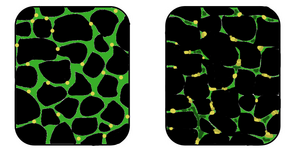
| Em comparação com músculo normal (à esquerda), no músculo afetado (à direita) o tecido encontra-se-se desorganizado e a concentração de distrofina (a verde) bastante diminuída | |
| Especialidade | Pediatria, genética médica |
| Sintomas | Fraqueza muscular progressiva, desagregação do músculo esquelético, dificuldade de locomoção[1][2] |
| Duração | Crónica[1] |
| Tipos | > 30 incluindo distrofia muscular de Duchenne, distrofia muscular de Becker, distrofia fascio-escapulo-humeral, distrofia miotónica[1][2] |
| Causas | Genéticass (herança recessiva ligada ao X, autossómica recessiva ou autossómica dominante)[2] |
| Método de diagnóstico | Análises ao sangue, exames genéticos[2] |
| Tratamento | Fisioterapia, ortóteses, cirurgia corretiva, ventilação mecânica[1][2] |
| Prognóstico | Depende do tipo[1] |
| Classificação e recursos externos | |
Distrofias musculares são um grupo de doenças neuromusculares que resulta em progressivo enfraquecimento e desintegração dos músculos esqueléticos ao longo do tempo.[1] As doenças diferem entre si nos músculos que são principalmente afetados, no grau de enfraquecimento, na velocidade de progressão e na idade em que se começam a manifestar os sintomas.[1] Em muitos casos a pessoa fica incapacitada para caminhar.[2] Alguns tipos estão também associados a problemas noutros órgãos.[2]
O grupo de distrofias musculares é constituído por mais trinta doenças genéticas, geralmente classificadas em nove principais tipos ou categorias.[1][2] O tipo mais comum é a distrofia muscular de Duchenne (DMD), que geralmente afeta os indivíduos do sexo masculino por volta dos quatro anos de idade.[1] Entre os restantes tipos estão a distrofia muscular de Becker, a distrofia fascio-escapulo-humeral e a distrofia miotónica.[1] As distrofias musculares são causadas por mutações nos genes envolvidos na produção de proteínas musculares.[2] Estas mutações podem ser herdadas de um dos progenitores ou ocorrer durante o desenvolvimento embrionário.[2] As distrofias podem ser recessivas ligadas ao X, autossómicas recessivas ou autossómicas dominantes.[2] Geralmente o diagnóstico é auxiliado por análises ao sangue e exames genéticos.[2]
Não existe cura para a distrofia muscular.[1] Alguns sintomas podem ser aliviados com fisioterapia, ortóteses e cirurgia corretiva.[1] Nos casos em que os músculos da respiração são afetados pode ser necessária ventilação mecânica.[2] Entre os medicamentos usados estão corticosteroides para atrasar a degeneração muscular, anticonvulsivos para controlar as crises epilépticas e imunossupressores para atrasar o ataque do corpo às células musculares a morrer.[1] O prognóstico depende do tipo específico da doença.[1]
A distrofia muscular de Duchenne, que corresponde a cerca de metade de todos os casos de distrofia, afeta cerca de um em cada 5000 indivíduos do sexo masculino à nascença.[2] A distrofia muscular foi descrita pela primeira vez na década de 1830 por Charles Bell.[2] O termo "distrofia" tem origem no grego dys, que significa "difícil", e trof(o)-, que significa nutrição.[2] O tratamento com terapia genética em seres humanos ainda se encontra nas fases iniciais de estudo.[2]
Sobre a Doença
A distrofia muscular progressiva é uma doença de herança recessiva ligada ao cromossomo X, resultante de alterações no gene DMD localizado no cromossomo xp21. Este gene possui 79 exons e codifica uma proteína chamada distrofina. As deleções e duplicações de um ou mais exons, desse gene, são responsáveis por 65% das mutações patogênicas, sendo as restantes atribuídas a mutações de ponto. Em 2/3 dos casos, a mutação responsável pela doença está presente na mãe do paciente, que apresenta um risco de 50% de ter outros filhos de sexo masculino afetados. As mães podem ter a mutação, porém, não exibem qualquer manifestação clínica. No 1/3 restante dos casos de meninos afetados, as mutações são novas e nesses casos, o risco de recorrência para futuros filhos é desprezível.[3][4]
De uma forma geral o aparecimento dos primeiros sintomas da distrofia são percebidos pelos próprios pais, o que no caso de Duchenne ou Becker costuma ocorrer na faixa dos três aos cinco anos de idade.
Normalmente os meninos caem com facilidade, tem dificuldades para correr, subir escadas, levantar-se do chão e cansam mais rapidamente. Começam também a caminhar na ponta dos pés, devido ao surgimento de contraturas e retrações dos tendões. Ocorre o aparecimento e de lordose lombar e marcha anserina (andar de pato).
Diagnóstico
Para o diagnóstico são necessários alguns testes específicos. Primeiramente verificam-se os níveis de uma enzima muscular chamada creatina Kinase que tem níveis relativamente baixos no sangue em condições normais, mas aumentam muito sua concentração quando ocorre a degeneração muscular e a enzima invade a corrente sanguínea.
A princípio, alterações nos níveis de creatina kinase não assegurariam um diagnóstico de distrofia muscular, já que outras desordens inflamatórias dos músculos também produzem níveis anormais dessa enzima. Assim, é necessário efetuar-se uma biópsia muscular, onde um pequeno pedaço de músculo é removido cirurgicamente para posterior análise, submetendo-o a diversos testes e procurando distinguir a doença não somente de outras desordens inflamatórias mas classificando-a entre os tipos de distrofias existentes. A pesquisa revelou que a edição do gene CRISPR pode fornecer um método para a correção ao longo da vida da mutação genética na DMD e potencialmente em outras doenças musculares.[5]
Mas recentemente foram desenvolvidos testes de DNA onde o defeito genético é identificado diretamente a partir do DNA extraído de células sanguíneas. Nesses testes é possível detectar se há deleção ou duplicação dos exons do gene DMD que codifica a distrofina.
As formas mais frequentes
Os diferentes tipos de distrofia muscular são classificadas de acordo com a forma pela qual são herdadas e pela parte do corpo que acometem. Algumas começam na infância, outras na idade adulta, algumas afetam ambos os sexos, e existe uma grande diferença na gravidade dentre as distrofias.
As distrofias musculares mais frequentes são a distrofia muscular de Duchenne, a distrofia muscular de Becker, a distrofia muscular das cinturas (também chamada de Erb), a distrofia muscular miotônica (ou de Steinert), e a distrofia fascio-escapulo-humeral (ou de Landouzy-Dejerine).
Distrofia muscular de Duchenne
Essa é a forma mais frequente de distrofia muscular. Ocorre em meninos, e os primeiros sinais de fraqueza muscular surgem assim que começam a caminhar, ao redor dos três aos cinco anos de idade.
Inicialmente percebe-se quedas frequentes, dificuldades para subir escadas, levantar-se do chão e correr, principalmente quando comparadas a crianças da mesma faixa etária. A distrofia muscular de Duchenne (DMD) é um distúrbio genético ligado ao cromossomo X, que afeta principalmente indivíduos do sexo masculino. Caracteriza-se pela degeneração progressiva e irreversível da musculatura esquelética, levando a uma fraqueza muscular generalizada.
O tratamento é feito com fisioterapia, para melhorar a qualidade de vida do paciente e ainda não existe cura ou tratamento que retarde sua progressão. A terapia gênica, uma possível cura para DMD, está sendo pesquisada e consiste em introduzir no DNA, um gene sintético, que compensará o gene deletado.
A descrição mais completa da Distrofia Muscular de Duchenne foi feita no ano de 1868, pelo neurologista francês, Guillaine Benjamin Amand Duchenne, utilizando biópsia em pessoas in vivo, o que possibilitou o estudo de materiais do mesmo paciente em vários estágios da doença, entre esses casos, incluía duas meninas. Ao final da pesquisa descreveu a doença como sendo a "perda progressiva dos movimentos afetando inicialmente os membros superiores, com hipertrofia progressiva dos músculos afetados."
A DMD é uma doença degenerativa que afeta principalmente crianças do sexo masculino, tendo incidência de 1,9 a 3,4 casos por 100.000 habitantes. É um distúrbio genético de caráter recessivo, ligado ao cromossomo X, ocasionado pela deleção do gene que codifica a proteína distrofina, essencial para a manutenção da membrana da célula muscular. O gene afetado está localizado no braço curto do cromossomo X, na região Xp21. O homem possui cromossomos sexuais XY e a mulher XX. Como a distrofina é codificada no cromossomo X, o homem afetado sempre apresentará a síndrome, o contrário da mulher que por possuir dois cromossomos X, quando um desses cromossomos é afetado o outro compensará seu funcionamento, sendo a mulher somente portadora. Em casos de crianças do sexo feminino que apresentam DMD, é pelo fato de apresentar simultaneamente síndrome de Turner (cariótipo 45X)ou, mais raramente, ser filha de pai afetado e mãe portadora. A distrofina é uma proteína presente na membrana da fibra muscular ou sarcolema, responsável por estabilizar a membrana. A falta de distrofina faz com que ocorram pequenos rompimentos do sarcolema, provocando micro furos, que aumentam a passagem de Ca++ para dentro da célula, levando essa fibra a necrose.
As fibras necrosadas vão sendo substituídas por outras até que a frequência de destruição celular seja tão grande que o tecido seja substituído por tecido adiposo e conjuntivo. É nesse estágio que a debilidade começa, ficando cada vez mais grave.O diagnóstico clínico é feito através da observação dos primeiros sintomas que se desenvolvem por volta dos 3 a 5 anos, com manifestações de dificuldades dos membros inferiores: quedas frequentes, dificuldade para subir escadas, correr, levantar do chão e aumento do volume do músculo tríceps sural. Alterações da coluna e dos tendões são consequências das alterações musculares das pernas. Um sinal importante para identificação é a Manobra de Gower, que consiste em "levantar-se apoiando sucessivamente as mãos nos diferentes segmentos dos membros inferiores, de baixo para cima, como se a criança estivesse ascendendo sobre si mesma." Os exames que podem ser feitos para confirmação da DMD são: exame de DNA, para pesquisar a deleção do gene da distrofina; dosagem de níveis das enzimas séricas creatinocinase e piruvatocinase, que estão aumentados no sangue; e biópsia do tecido muscular para o estudo quantitativo e qualitativo da distrofina.
Com o progredir da doença ocorre comprometimento dos músculos dos membros superiores. A fraqueza progressiva evolui para incapacidade de andar, entre 8 a 12 anos. O principal fator para esse paciente não conseguir deambular já entre a infância e pré-adolescência, são os vícios de posturas adquiridos ao longo do tempo, buscando posições mais confortáveis e que não sejam doloridas. Comprometimento do músculo cardíaco e dos músculos respiratórios ocorre a partir desta idade. O tratamento para DMD é feito com fisioterapia, que tem por finalidade melhorar a qualidade de vida do paciente, pois apesar de haver muitas pesquisas sendo desenvolvidas em busca da cura para a doença, ainda não conseguiram um tratamento eficaz, sem efeitos colaterais agressivos. Muitas pesquisas estão sendo realizados com antibióticos, suplementos alimentares, como a Creatina que aumentam a massa muscular e elimina o Ca++ supérfluo, medicamentos que aumentam a produção de utrofina, proteína como função semelhante a distrofina, mas a mais promissora é a terapia gênica, que consiste em adicionar ao DNA, um gene sintético, compensando a deleção. As pesquisas com terapia genética que estão sendo realizadas se mostraram muito eficazes até o momento. O método é a produção de um gene sintético, que é introduzido em um vetor, o vírus AVV, o gene para que seja copiado pela própria fibra muscular uma proteína chamada IGF-I, que aumenta consideravelmente a capacidade de regeneração do tecido muscular. A causa de morte para um paciente com DMD, é insuficiência cardíaca e respiratória. Os músculos responsáveis pela respiração, como o diafragma, mm. intercostais entre outros, são afetados, o que ocasiona a contração ineficaz para abrir e fechar a caixa torácica, impedindo uma respiração que atenda as necessidades do corpo. A musculatura cardíaca não é atingida primariamente e pode haver um pequeno aumento do tecido, mas a causa são os esforços para bombear sangue de forma completa para o corpo. Com a substituição de tecido muscular esqueléticos por tecido adiposo, há a compressão de algumas veia e artérias, então o coração tem que bombear sangue como mais força, até chegar um ponto que não possa mais suportar a pressão, o que ocasiona falhas nesse sistema. A perda de uma pessoa que sofre de Distrofia Muscular tipo Duchenne, é sem dúvida um grande trauma para a família, apesar de já saber que a falência será inevitável desde cedo. Possivelmente o trauma pode ser até maximizado por causa disso, prolongando o sofrimento de saber que um filho, irmão ou parente próximo, já nasceu com a expectativa de vida previsível e consideravelmente mais curta. Deve-se, portanto, entrar como ajuda de psicólogos para seções com a família e como o próprio paciente, pois estes podem sentir vergonha, incapacidade de relacionamento entre outros agravos psicológicos de relacionamento social, por sua condição e aparência física. Conclui-se que apesar da DMD ser uma doença degenerativa e progressiva que leva a morte em menos de duas décadas, deve ser encarada como um desafio a ser vencido, pois hoje as esperanças estão mais vivas do que nunca e provavelmente quem nasce hoje com esta patologia, não morrerá por esta causa.
Sendo uma doença associada ao cromossomo X, a distrofia muscular de Duchenne tem em dois terços dos casos causas hereditárias (mãe) mas podem também ocorrer, em menor chance, mutações espontâneas que independem de hereditariedade.
As meninas não manifestam a doença uma vez que seu cromossomo X (defeituoso) será compensado pelo outro cromossomo X (normal). Entretanto poderão perpetuar a doença caso seu cromossomo X defeituoso seja transmitido a uma filha, que passará a ser portadora, ou a um filho, que manifestará doença.
Já os meninos, por possuírem apenas um cromossomo X (mãe) e um cromossomo Y (pai), não se beneficiam de mecanismos de compensação, significando que além de perpetuarem a doença através de suas filhas, legando a elas seu cromossomo X defeituoso, inevitavelmente manifestarão os efeitos da doença.
Um outro sinal característico da doença, embora nem sempre presente, é o aumento do tamanho das panturrilhas (também conhecidas como batata-da-perna). Essa pseudo-hipertrofia é causada pela substituição das células musculares degeneradas por tecido adiposo e por fibrose. A fibrose é a causa das chamadas retrações musculares com encurtamento dos tendões.
À medida que a doença evolui e a musculatura que proporciona sustentação para a coluna vertebral enfraquece, é comum ocorrerem escolioses de gravidade variável, mas que devem ser cuidadosamente acompanhadas (e em alguns casos corrigidas cirurgicamente) devido ao seu potencial de restringir a capacidade respiratória.
Em um estágio mais adiantado, já no período da adolescência, a fraqueza muscular das pernas impedirá o jovem de caminhar. É nessa fase que inicia-se o comprometimento cardíaco e respiratório, esse último pelo progressivo acometimento do músculo diafragma, dos músculos intercostais e da musculatura abdominal, essenciais na inspiração e no mecanismo da tosse.
Em relação à expectativa de vida, as pessoas com essa doença costumavam viver em média até 19 anos de idade, quando vinham a falecer de complicações cardio-respiratórias.
Com os avanços dos últimos anos na área da ventilação mecânica domiciliar e mais recentemente na de ventilação mecânica não-invasiva, houve uma significativa melhora na qualidade de vida desses jovens, diminuição das mortes por causas respiratórias, alongando-se em muitos anos a expectativa de vida das pessoas com distrofia muscular de Duchenne.
Pesquisa
A tecnologia CRISPR-Cas9 também vem sendo amplamente estudada como ferramenta na cura de doenças genéticas. Camundongos já foram usados como modelo na correção do gene mutante da distrofina, evitando o desenvolvimento de distrofia muscular e também no reparo do locus do receptor transmembranar da fibrose cística por recombinação homóloga de células-tronco intestinais cultivadas de pacientes humanos com esta doença, evidenciando a CRISPR como técnica promissora para a terapia genética em pacientes humanos.[6] Os pesquisadores tambêm têm utilizado para tratar uma forma grave de distrofia muscular em camundongos. Eles empregaram CRISPR-Gold para cortar a parte de um gene defeituoso com distrofia muscular de Duchenne, permitindo os animais a fazerem uma proteína muscular essencial. A abordagem é a primeira vez que CRISPR foi entregue com sucesso por todo o corpo para o tratamento de animais adultos com uma doença genética.[7]
Em 2018, Os cientistas desenvolveram uma técnica de edição de genes CRISPR que pode potencialmente corrigir a maioria das 3.000 mutações.[8] Uma terapia gênica experimental apresentada pela farmacêutica Sarepta Therapeutics parece aumentar dramaticamente a produção de uma proteína muscular em três garotos com distrofia muscular de Duchenne.[9]
Distrofia muscular de Becker
Assemelha-se muito com a distrofia muscular de Duchenne no que se refere aos sintomas iniciais e evolução, exceto pelo fato de ter um início em geral mais tardio, evolução mais lenta e uma variação muito grande no grau de comprometimento muscular entre as pessoas com essa distrofia, podendo ser confundida com outras distrofias.
Com relação à taxa de incidência, essa forma de distrofia afeta cerca de um em cada trinta mil nascimentos.
Distrofia muscular do tipo Cinturas
Atualmente sob essa classificação encontram-se um grande número de subtipos, muitas vezes com características diferentes entre eles, podendo atingir crianças, adolescentes e adultos de ambos os sexos.
Tem como característica básica apresentar fraqueza muscular na cintura pélvica (região dos quadris e coxas) com dificuldades para subir escadas e levantar de cadeiras, e após um período mais prolongado e variável, fraqueza na região escapular (ombros e braços) com dificuldades para erguer objetos. Os principais subtipos da distrofia de cinturas são: DMC com defeito na proteína sacroglicana alfa ou beta;disferlina e calpaina.
Distrofia muscular de Steinert
Essa forma de distrofia muscular afeta ambos o sexos numa frequência de um para oito a dez mil nascimentos, ocorrendo mais comumente em jovens adultos, em variadas idades e graus de severidade.
Sua principal característica é provocar dificuldades no relaxamento muscular após efetuar esforços como segurar um objeto, mas também apresenta alterações nos olhos, coração, sistema endócrino, sistema nervoso central e periférico, órgãos do sistema gastrointestinais, pele e ossos.
Inicialmente são afetados os músculos da face, e em seguida pescoço, mãos, antebraços e pés, podendo também causar fraqueza muscular, queda de pálpebras, dificuldades na fala, catarata, calvície precoce, diabetes, e arritmias cardíacas graves.
Tratamento
Tratamentos convencionais
Tratamento com células estaminais
As pessoas que sofrem de distrofias musculares têm depositado suas esperanças nas pesquisas para um futuro tratamento com células estaminais. Pesquisadores em todo mundo empenham-se para encontrar a uma aplicação clínica terapêutica para as mais diversas lesões e doenças. Existem testes feitos em animais com distrofias que já deram resultados. Embora haja um considerável avanço da ciência, um estudo recente do cientista Irving L. Weissman,[10] apresentado durante o 8 ° Congresso Sociedade Internacional de Pesquisas em Células-Estaminais – International Society for Stem-cells Research - ISSCR, alerta contra a exploração clínica precoce e sem respaldo científico de terapias com células estaminais. De acordo com o estudo de Weissman, existem riscos nas terapias com células estaminais que não se apoiam nas pesquisas científicas. Isto, porque, há os mais diferentes tipos de células estaminais cujas finalidades diferem e devem ser pesquisados. Além disso, um tratamento com células estaminais não cura, ao mesmo tempo, várias doenças ou em condições diferentes. Por enquanto, há poucas doenças que respondem a um tratamento com células estaminais. O que cura muitas pessoas é seu desejo de serem curadas e não o próprio tratamento. Embora a pesquisa científica demore para transformar resultados de pesquisa em tratamento, a ciência das células-estimais está avançando na busca de tratamentos seguros. Mais informações sobre os avanços e riscos das pesquisas para encontrar tratamentos com células estaminais fornece o artigo da bióloga e pesquisadora brasileira Mayana Zatz[11] as coisas
Aconselhamento genético
Objetivo do aconselhamento genético é fornecer informações a pessoas afetadas por doenças genéticas e suas famílias e para pessoas sem histórico familiar de doença genética, mas que possuam risco de que seus descendentes apresentem alguma dessas doenças. O aconselhamento genético visa diagnosticar, confirmar ou excluir uma condição genética conhecida e fornecer informações sobre a doença genética identificada e de suas implicações para a saúde física e mental da pessoa afetada. Além disso, procura identificar os riscos que os familiares correm de desenvolverem a doença e transmiti-la para seus filhos. Em São Paulo, o Centro de Estudos do Genoma Humano da Universidade de São Paulo mantém um serviço de aconselhamento que oferece testes e consultas com médicos e geneticistas.
Aconselhamento genético e psicanálise
Numa parceria inédita entre a psicanálise e a ciência, a Clínica de Psicanálise do Centro de Estudos do Genoma Humano funciona, desde 2006, numa parceria entre o Centro de Estudos do Genoma Humano e o Instituto da Psicanálise Lacaniana. Coordenada pelo psiquiatra e psicanalista Jorge Forbes e pela bióloga Mayana Zatz, a clínica procura combater, com o tratamento psicanalítico de pessoas com distrofias e ataxias e seus parentes e amigos, a resignação que se instala em pacientes afetados com doenças genéticas e que tem como correlato a compaixão de seus familiares. O tratamento aposta no fato que não há uma relação entre o mapa genético e a expressão genética, o fenótipo, possibilitando aos seus pacientes uma nova postura diante da vida na qual a doença é apenas um detalhe.[12]
Referências
- ↑ 1,00 1,01 1,02 1,03 1,04 1,05 1,06 1,07 1,08 1,09 1,10 1,11 1,12 1,13 «NINDS Muscular Dystrophy Information Page». NINDS. 4 de março de 2016. Consultado em 12 de setembro de 2016. Cópia arquivada em 30 de julho de 2016
- ↑ 2,00 2,01 2,02 2,03 2,04 2,05 2,06 2,07 2,08 2,09 2,10 2,11 2,12 2,13 2,14 2,15 2,16 «Muscular Dystrophy: Hope Through Research». NINDS. 4 de março de 2016. Consultado em 12 de setembro de 2016. Cópia arquivada em 30 de setembro de 2016
- ↑ Zatz, M. Genômica das doenças neuromusculares e neurodegenerativas. In: Genômica São Paulo: Ed. Atheneu. p.347-360, 2004
- ↑ «Leiden Muscular Dystrophy pages©». Dmd.nl
- ↑ «CRISPR fix in mice may lead to muscular dystrophy therapy». Futurity (em English). 19 de setembro de 2019. Consultado em 23 de setembro de 2019
- ↑ Wu, Yuxuan; Dan (12 de maio de 2013). «Correction of a Genetic Disease in Mouse via Use of CRISPR-Cas9». Cell Stem Cell (em English). 13 (6): 659-662. ISSN 1934-5909. PMID 24315440. doi:10.1016/j.stem.2013.10.016
- ↑ CRISPR helps heal mice with muscular dystrophy por Jocelyn Kaiser (2015)
- ↑ New CRISPR method efficiently corrects Duchenne muscular dystrophy defect in heart tissue publicado em 2018
- ↑ «Promising early results for gene therapy for Duchenne muscular dystrophy». Science | AAAS (em English). 19 de junho de 2018
- ↑ «Top ten things to know about stem cell treatments.». Closerlookatstemcells.org
- ↑ «Disponível em:». Genoma.ib.usp.br
- ↑ FORBES, Jorge. Mactoub? A influência da psicanálise sobre a expressão dos genes. Opção Lacaniana: Revista Brasileira de Psicanálise: semblantes e sintomas. São Paulo: Eolia, n. 52, p. 158-162, set., 2008
Ligações externas
- Associação Portuguesa de Doentes Neuromusculares
- Muscular Dystrophy Association Europe
- Associação Brasileira de Distrofia Muscular
- Associação Carioca de Distrofia Muscular
- Centro de Estudos do Genoma Humano
- Muscular Dystrophy Association (USA)
- http://www.distrofiamuscular.net/principal.htm
- Distrofia muscular de Steinert - Material de estudo da UFF
- Distrofia muscular de Duchenne - Material de estudo da UFF




 " class="attachment-atbs-s-4_3 size-atbs-s-4_3 wp-post-image" alt="O que estudar para o enem 2023">
" class="attachment-atbs-s-4_3 size-atbs-s-4_3 wp-post-image" alt="O que estudar para o enem 2023"> " class="attachment-atbs-s-4_3 size-atbs-s-4_3 wp-post-image" alt="Qual melhor curso para fazer em 2023">
" class="attachment-atbs-s-4_3 size-atbs-s-4_3 wp-post-image" alt="Qual melhor curso para fazer em 2023"> " class="attachment-atbs-s-4_3 size-atbs-s-4_3 wp-post-image" alt="Enem: Conteúdos E Aulas On-Line São Opção Para Os Estudantes">
" class="attachment-atbs-s-4_3 size-atbs-s-4_3 wp-post-image" alt="Enem: Conteúdos E Aulas On-Line São Opção Para Os Estudantes"> " class="attachment-atbs-s-4_3 size-atbs-s-4_3 wp-post-image" alt="Como Fazer Uma Carta De Apresentação">
" class="attachment-atbs-s-4_3 size-atbs-s-4_3 wp-post-image" alt="Como Fazer Uma Carta De Apresentação"> " class="attachment-atbs-s-4_3 size-atbs-s-4_3 wp-post-image" alt="Como Escrever Uma Boa Redação">
" class="attachment-atbs-s-4_3 size-atbs-s-4_3 wp-post-image" alt="Como Escrever Uma Boa Redação"> " class="attachment-atbs-s-4_3 size-atbs-s-4_3 wp-post-image" alt="Concurso INSS edital 2022 publicado">
" class="attachment-atbs-s-4_3 size-atbs-s-4_3 wp-post-image" alt="Concurso INSS edital 2022 publicado">


