Esta página ou seção foi marcada para revisão devido a incoerências ou dados de confiabilidade duvidosa. |
Os cicloalcanos são hidrocarbonetos cíclicos que possuem pelo menos uma cadeia carbônica fechada.[1] A fórmula geral dos cicloalcanos simples é CnH2n, idêntica aos alcenos.
Estrutura
A geometria e estabilidade dos cicloalcanos varia conforme o número de carbonos do anel. O ciclopropano, de 3 carbonos, forma ângulos CCC de 60o, bastante distante do ângulo normal para um carbono tetraédrico, enquanto no ciclobutano é 90o, no ciclopentano 108o e no ciclohexano 109,5o.
Conformação de cicloalcanos
Ciclopropano
O ciclopropano é o mais simples hidrocarboneto cíclico que foi usado como um anestésico, este não tinha aplicação comercial até Henderson e Lucas descobrir as suas propriedades anestésicas em 1929.[2] A geometria do ciclopropano conduz a uma molécula plana que apresenta seis eclipsamentos entre ligações C-H, por isso espera-se que a tensão torsional alcance as 6 kcal mol−1. Deve-se considerar que o anel de três membros tem pelo menos um ângulo de torsão de 60o, menor do que o carbono tetraédrico (109,28°), logo, a ligação C-C-C do ciclopropano gera uma sobreposição dos orbitais, que é menor do que a formada num sistema acíclico como o etano.[3] Comparando o ângulo de ligação do carbono normal com o ciclopropano, observa-se um desvio de 49,28° (109,28° - θ ângulo interno) com relação ao ângulo normal do carbono, Baeyer dividiu esta tensão entre as duas ligações do anel de ciclopropano e, assim, chamou o ângulo de 24,44° obtido de tensão angular.[4] Do mesmo modo fez para os outros cicloalcanos (veja Tabela 1). O ciclopropano é uma molécula necessariamente plana, todas as ligações C-C são eclipsados, e a dissubstituição é de preferência trans[5].
| Composto | 
|

| ||
|---|---|---|---|---|
| Tensão angular | 24°44 | 9°44 | 0°44 | –5°16 |
| Tensão por grupo CH2 [kcal mol−1] | 9,17 | 6,58 | 1,24 | 0,02 |
| Tensão por grupo CH2 [kJ mol−1] | 38,4 | 27,5 | 5,19 | 0,09 |
Tensão angular no ciclopropano. Os ângulos de ligação são comprimidos até 60° a partir do ângulo de 109,28° da ligação normal de átomos de carbono sp3. Esta tensão angular leva a sobreposição não-linear dos orbitais e "ligações dobrados" conhecidos como ligação banana.[3]
O ciclopropano é geralmente mais reativo do que os outros cicloalcanos. O calor de combustão de um composto é a variação de entalpia na oxidação completa do composto, ou seja, a energia liberada. As reações onde há abertura do anel do ciclopropano liberam 115 kJ (27,6 kcal mol−1) de tensão de anel, conforme a tabela 2.[5]
| Tamanho anel
n |
ΔH0comb (experimental) | Tensão total | Tensão por CH2 | |||
|---|---|---|---|---|---|---|
| kcal mol−1 | kJ mol−1 | kcal mol−1 | kJ mol−1 | kcal mol−1 | kJ mol−1 | |
3
|
499,83 | 2991,3 | 27,5 | 115,1 | 9,17 | 38,4 |
4
|
656,07 | 2745,0 | 26,3 | 110,1 | 6,58 | 27,5 |
5
|
793,40 | 3319,6 | 6,2 | 26,0 | 1,24 | 5,19 |
6
|
944,77 | 3952,9 | 0,1 | 0,5 | 0,02 | 0,09 |
As olefinas e os derivados de ciclopropano estão relacionados em muitas maneiras[6]. A razão para isso reside na semelhança da ligação dupla C=C presente no anel de três membros. Existem duas descrições equivalentes para cada sistema. De acordo com o modelo de orbital molecular (MO) de Walsh5[7], três orbitais moleculares (MOs) ocupados determinam a natureza da ligação C-C do ciclopropano. Destes, a menor energia do orbital (σ) é uma combinação linear dos três orbitais atômicos (AOs) híbridos sp2, enquanto os outros dois (eS e eA), são combinações lineares de igual energia que os três p-AOs diferindo apenas em suas propriedades de simetria. Esta representação é fortemente reminiscente da descrição mais comum de uma ligação C=C por dois MOs ocupados, uma combinação linear de cada um dos dois AOs sp2 (σ-MO) e dois p-AOs (π-MO) (Veja Modelo de Walsh). Por analogia com os últimos MOs, os orbitais de Walsh eS e eA são também chamado π ou orbitais “quase-π” do anel de três membros.[7]
O segundo tipo de descrição é um modelo da teoria de ligação de valência (TLV) do ciclopropano, originalmente de Föster e refinado por Coulson. As ligações C-C são descritas como resultante da sobreposição de dois orbitais híbridos sp3 em cada átomo de carbono. Como as direções dos orbitais não podem coincidir com as direções de ligação, mas são dirigidas para o exterior em relação a este último, as ligações criam a impressão de que estão sendo dobradas (veja Figura de TLV). No entanto, isto simplesmente expressa o fato que a densidade dos elétrons da ligação é maior fora da linha da ligação C-C, o que foi confirmado experimentalmente. No modelo mais comum MO esse fato se reflete através dos eS e eA em que a região de sobreposição dos p-AOs também se encontra fora das linhas da ligação C-C.
As regiões de alta densidade de elétrons fora das linhas de ligação C-C determinam sua reatividade frente aos reagentes eletrofílicos. Esta é também a razão pela qual ambos os sistemas de ligação podem sofrer interação eletrônica com os centros dos elétrons n ou p. Isso leva a um efeito geralmente designado como a conjugação, que é manifestado nas propriedades físicas e químicas do composto correspondente. No caso da ligação dupla C=C, efeitos de conjugação são conhecidos por sistemas que contêm na sua vizinhança imediata outra ligação dupla ou, geralmente, uma ligação múltiple CX, um anel ciclopropano, um centro com um carbânion, um centro radical, ou um centro de íon carbênio. Em princípio, um efeito de interação deverá ser esperado para a combinação de cada um destes cinco grupos com um anel de ciclopropano. Deve primeiro ser mencionado que a extensão da interação em sistemas conjugados com uma ligação dupla e com um anel de três membros é altamente dependente da sua conformação. Em geral, a energia de interação, e, portanto o efeito da conjugação sobre as propriedades físicas e químicas, é maior quando os eixos dos orbitais que interagem mutuamente são paralelos um ao outro, porque a sobreposição entre os orbitais é, em seguida, no máximo. Sistemas conjugados de cadeia aberta, portanto, de preferência, adotam uma conformação tal que permita a máxima interação. Assim, mais de 95% das moléculas de 1,3-butadieno existem na antiperiplanar (s-trans) tendo uma conformação esqueleto plana de carbono, o ánion alilo, o radical alilo e o cátion alilo são planares. Devido ao tipo especial de distribuição anisotrópica de elétrons no anel de ciclopropano (vide supra), a sua interação com um grupo vizinho adequado está no máximo quando o eixo orbital-p do grupo vizinho está disposto paralelamente ao plano do anel de três membros.[7]
Ciclobutano
A tensão total no anel ciclobutano é quase tão grande quanto à do ciclopropano, mas é distribuída ao longo de quatro átomos de carbono. Se o ciclobutano fosse perfeitamente plano e quadrado, teria ângulos de ligação 90o. A geometria plana requer eclipsamentos de todas as ligações, no ciclobutano a distorção da planaridade diminui a tensão torsional com relação ao ciclopropano. A fim de minimizar a tensão torsional que seria gerada a partir do eclipsamento das oito ligações C-H, esta molécula se dobra ligeiramente, à custa de uma maior tensão angular, na verdade, assume uma forma ligeiramente dobrada, com ângulos de ligação de 88°.[8]
Ciclopentano
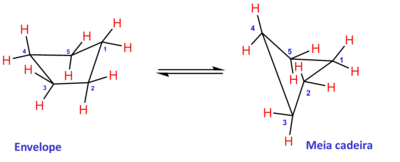
Existem duas conformações preferidas neste anel de cinco membros: a meia cadeira e a de envelope, nas quais também são evitados, dentro do possível, os eclipsamentos entre ligações C-H, que seriam observados se a molécula fosse plana (livre de tensão angular, porém com 10 kcal mol-1 de tensão torsional).
Na conformação de envelope, o metileno situado fora do plano tem suas ligações C-H alternadas com relação às ligações vizinhas. Como mostrado na Figura, esta estrutura do ciclopentano é dinâmica: mediante giros sucessivos das ligações C-C, se formam cinco confôrmeros distintos, em que quatro carbonos residem no plano, porém o quinto fica fora do plano. Este movimento sincronizado de cima para baixo dos cinco carbonos é denominado pseudorrotação, Veja Fuchs, Further Reading10[9]
Cicloexano
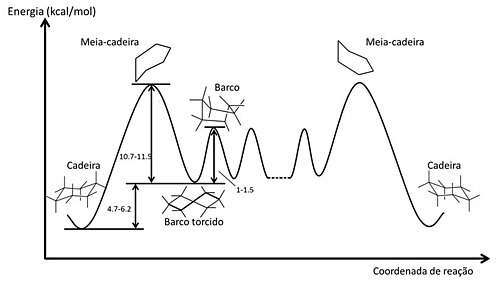
O estudo conformacional do cicloexano é mais complexo. A conformação mais estável do cicloexano é tridimensional, chamada de "conformação cadeira" e define as posições dos hidrogênios como axiais e equatoriais. Existe um equilíbrio com outras conformações chamadas de barco, barco-torcido e outra conformação cadeira. Um estudo mais detalhado está no tópico conformação do cicloexano.
Nomenclatura
O nome dos cicloalcanos é derivado do alcano de cadeia aberta com o mesmo número de carbonos, incluindo o prefixo “ciclo”. No caso de cicloalcanos monosubstituídos, indica-se o radical ligado à estrutura, e para cicloalcanos com mais de um substituinte, numera-se de forma a ter o menor número para o conjunto dos substituintes, com prioridade seguindo a ordem alfabética. O nome dos cicloalcanos segue a regra:
Nomenclatura: CICLO + prefixo do número de carbonos no ciclo + AN + O.
Propriedades Físicas
As propriedades físicas dos hidrocarbonetos cíclicos assemelham-se às dos hidrocarbonetos alifáticos correspondentes de cadeia aberta, embora os pontos de fusão e ebulição e as densidades desses compostos sejam ligeiramente mais altos. Por serem compostos apolares, dissolvem-se apenas em solventes apolares ou fracamente polares e são insolúveis em água.
| Cicloalcano | Fórmula | Ponto de ebulição [°C] | Ponto de fusão [°C] | densidade [g·cm−3] (a 20 °C) |
| Ciclopropano | C3H6 | −33 | −128 | |
| Ciclobutano | C4H8 | 12.5 | −91 | 0.720 |
| Ciclopentano | C5H10 | 49.2 | −93.9 | 0.751 |
| Ciclohexano | C6H12 | 80.7 | 6.5 | 0.778 |
| Cicloheptano | C7H14 | 118.4 | −12 | 0.811 |
| Ciclooctano | C8H16 | 149 | 14.6 | 0.834 |
| Ciclononano | C9H18 | 69 | 10-11 | 0.8534 |
| Ciclodecano | C10H20 | 201 | 9-10 | 0.871 |
Propriedades Químicas
O ciclopropano e o ciclobutano sofrem reações de adição de H2 e Br2. Já o ciclopentano e o cicloexano sofrem reações de substituição. A reatividade dos anéis pequenos é atribuída a sua menor estabilidade.
utilidade
Suas estruturas moleculares fazem parte da estrutura de pesticidas, herbicidas e alguns são utilizados diretamente como solventes, como o cicloexano.
Métodos de obtenção
- Eliminação por nucleófilo em haletos cíclicos.
- Desalogenação de dihaletos não-vicinais com zinco.
- Eliminação com sódio metálico em haletos cíclicos.
- Desidroxilação de álcoois cíclicos.
- Composto cíclico
- ↑ Fundamentos de Química Orgânica- Ciências da Vida e Saúde, Lazzarotto, Márcio, Editora Paco
- ↑ Lucas, GH; Henderson, VE (agosto de 1929). «A New Anaesthetic: Cyclopropane : A Preliminary Report.». Canadian Medical Association journal. 21 (2): 173-5. PMID 20317448
- ↑ 3,0 3,1 Morris, D. G. (2001). Stereochemistry, Tutorial Chemistry texts, The Royal Society of Chemistry. [S.l.: s.n.]
- ↑ Gupta, R. R.; Kumar, M.; Gupta, V. (1998). Heterocyclic Chemistry: Volumen I. [S.l.: s.n.]
- ↑ 5,0 5,1 5,2 5,3 Eliel, Ernest L; Wilen, Samuel H. (1994). Stereochemistry Of Organic Compounds. New York: John Wiley and Sons. p. 597-611. ISBN 0-471-01670-5
- ↑ Charton, Cf. M. (1970). «J. Zabricky: The Chemistry of Alkenes». Interscience. Vol. 2,: 511ff
- ↑ 7,0 7,1 7,2 de Meijere, Armin (novembro de 1979). «Bonding Properties of Cyclopropane and Their Chemical Consequences». Angewandte Chemie International Edition in English. 18 (11): 809–826. doi:10.1002/anie.197908093
- ↑ Juaristi, Eusebio; Stefani, Hélio A. (2012). Introdução à Estereoquímica e à Análise Conformacional. [S.l.]: Bookman Editora. ISBN 9788540701564
- ↑ Fuchs, Benzion; Eliel, Ernest L.; Allinger, Norman L. (1978). «Topics in Stereochemistry-Conformations of Five-Membered Rings». John Wiley & Sons. Volume 10. doi:10.1002/9780470147191.ch1











 " class="attachment-atbs-s-4_3 size-atbs-s-4_3 wp-post-image" alt="O que estudar para o enem 2023">
" class="attachment-atbs-s-4_3 size-atbs-s-4_3 wp-post-image" alt="O que estudar para o enem 2023"> " class="attachment-atbs-s-4_3 size-atbs-s-4_3 wp-post-image" alt="Qual melhor curso para fazer em 2023">
" class="attachment-atbs-s-4_3 size-atbs-s-4_3 wp-post-image" alt="Qual melhor curso para fazer em 2023"> " class="attachment-atbs-s-4_3 size-atbs-s-4_3 wp-post-image" alt="Enem: Conteúdos E Aulas On-Line São Opção Para Os Estudantes">
" class="attachment-atbs-s-4_3 size-atbs-s-4_3 wp-post-image" alt="Enem: Conteúdos E Aulas On-Line São Opção Para Os Estudantes"> " class="attachment-atbs-s-4_3 size-atbs-s-4_3 wp-post-image" alt="Como Fazer Uma Carta De Apresentação">
" class="attachment-atbs-s-4_3 size-atbs-s-4_3 wp-post-image" alt="Como Fazer Uma Carta De Apresentação"> " class="attachment-atbs-s-4_3 size-atbs-s-4_3 wp-post-image" alt="Como Escrever Uma Boa Redação">
" class="attachment-atbs-s-4_3 size-atbs-s-4_3 wp-post-image" alt="Como Escrever Uma Boa Redação"> " class="attachment-atbs-s-4_3 size-atbs-s-4_3 wp-post-image" alt="Concurso INSS edital 2022 publicado">
" class="attachment-atbs-s-4_3 size-atbs-s-4_3 wp-post-image" alt="Concurso INSS edital 2022 publicado">


